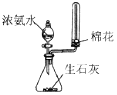
题目内容
13.下列有关钠元素及其化合物的表示正确的是( )| A. | 钠原子的结构示意图: | |
| B. | 过氧化钠的电子式: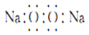 | |
| C. | 小苏打在水中的电离方程式:NaHCO3═Na++HCO3- | |
| D. | 硫化钠的水溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
分析 A.钠原子核外有3个电子层;
B.过氧化钠为离子化合物;
C.小苏打为强电解质,完全电离;
D.硫离子水解分步进行,以第一步水解为主.
解答 解:A.钠原子的结构示意图为 ,故A错误;
,故A错误;
B.过氧化钠的电子式为 ,故B错误;
,故B错误;
C.小苏打为强电解质,在水中的电离方程式为NaHCO3═Na++HCO3-,故C正确;
D.硫化钠的水溶液呈碱性的原因为S2-+H2O?HS-+OH-,故D错误;
故选C.
点评 本题考查化学用语,为高频考点,把握电子式、结构示意图、电离及水解方程式为解答的关键,侧重分析与应用能力的考查,注意化学用语的区别及规范使用,题目难度不大.

练习册系列答案
相关题目
4. 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
(1)汽车发动机工作时会引起反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.2 000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=0.0015mol•L-1•min-1,N2的平衡转化率为0.75%,2 000 K时该反应的平衡常数K=2.25×10-4;
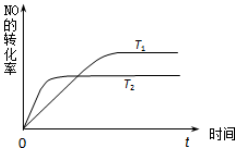
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示.
①反应2NO(g)?N2(g)+O2(g)为放热反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g)?N2(g)+O2(g)已达到平衡的是c(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4mol NO,同时生成2molN2
③在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mo1)如表所示.相同条件下达到平衡后,N2的体积分数最大的是D(填容器代号);
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CH4催化还原NO2消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:(1)汽车发动机工作时会引起反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.2 000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=0.0015mol•L-1•min-1,N2的平衡转化率为0.75%,2 000 K时该反应的平衡常数K=2.25×10-4;
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示.
①反应2NO(g)?N2(g)+O2(g)为放热反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g)?N2(g)+O2(g)已达到平衡的是c(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4mol NO,同时生成2molN2
③在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mo1)如表所示.相同条件下达到平衡后,N2的体积分数最大的是D(填容器代号);
| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
已知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
1.短周期元素W、X、Y、Z,原子序数依次增大,原子半径rw<rx<ry,Y的原子最外层只有一个电子,X与Z同主族,且Z的原子序数是X的两倍,下列有关叙述错误的是( )
| A. | W一定是氢元素 | |
| B. | 简单离子半径rz>rx>ry | |
| C. | 标准状况下,1mol Z的最高价氧化物的体积约为22.4L | |
| D. | 工业上常用电解熔融Y的氯化物的方法制备Y单质 |
8.在给定的条件下,下列物质间转化均能实现的是( )
| A. | Al2O3$→_{△}^{H_{2}}$Al$→_{常温}^{浓H_{2}SO_{4}}$Al2(SO4)3 | |
| B. | H2SiO3$\stackrel{△}{→}$SiO2$→_{△}^{盐酸}$SiCl4 | |
| C. | SO2$\stackrel{CaCl_{2}(aq)}{→}$CaSO3$\stackrel{O_{2}}{→}$CaSO4 | |
| D. | CH3CH3$→_{光照}^{Cl_{2}}$CH3CH2Cl$→_{△}^{NaOH醇溶液}$CH2=CH2 |
18.某有机物是一种医药中间体.其结构简式如图所示.下列有关该物质的说法正确的是( )
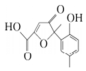

| A. | 该化合物分子中不含手性碳原子 | |
| B. | 该化合物与NaHCO3溶液作用有CO2气体放出 | |
| C. | 1 mol该化合物与足量溴水反应,消耗2 mol Br2 | |
| D. | 在一定条件下,该化合物与HCHO能发生缩聚反应 |
5.西维因是一种高效低毒杀虫剂,在一定条件下可发生水解反应:

有关说法正确的是( )

有关说法正确的是( )
| A. | 西维因分子式为C12H10NO2 | |
| B. | 西维因分子中至少有21个原子共平面 | |
| C. | 1mol西维因最多能与6mol氢气发生加成反应 | |
| D. | 取一段时间后的混合液,先用盐酸酸化,再滴加FeCl3溶液,可检验西维因是否发生水解 |
2.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 重大节日期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 小苏打是制作馒头和面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 | |
| C. | 为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放 |
14.室温下,下列溶液等体积混合后pH一定大于7的是( )
| A. | pH=3的醋酸与pH=11的氢氧化钾 | B. | 0.1mol/L的盐酸与0.1mol/L的氨水 | ||
| C. | 0.001mol/L的盐酸与pH=11的氨水 | D. | pH=3的盐酸与0.001mol/L的氨水 |