题目内容
 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
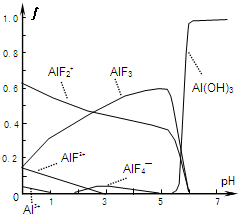
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是(2)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒百分含量f随pH的分布曲线如图示.用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1500 | 1800 | 2400 |
| 平衡常数K | 8.0×10-5 | 3.0×10-4 | 6.4×10-3 |
Ⅲ.已知:常温下柠檬酸(H3C6H5O7)和氢氰酸(HCN)的电离平衡常数:
| 电离平衡常数 | |||
| 柠檬酸 | Ka1=7.1×10-4 | Ka2=1.68×10-5 | Ka3=4.1×10-7 |
| 氢氰酸 | Ka=4.93×10-10 | ||
考点:电解原理,反应热和焓变,焓变和熵变,弱电解质在水溶液中的电离平衡
专题:基本概念与基本理论
分析:Ⅰ(1))氟化氢是共价化合物,纯液态不导电;阳极发生氧化反应,HF2-在阳极上放电,生成F2与H+;
(2)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-;
Ⅱ(1)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO,说明该反应难以进行,反应的活化能高;
(2)根据图表中的平衡常数随温度变化趋势是,温度越高,K值越大;因反应在高温下能自发,所以△S>0;
Ⅲ、A是柠檬酸二氢钠(NaH2C6H5O7)溶液,H2C6H5O7-电离强于水解显酸性,pH小于7;B溶液是氰化钠和氢氰酸等浓度的混合溶液,CN-水解强于HCN的电离,溶液显碱性,pH大于7.
(2)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-;
Ⅱ(1)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO,说明该反应难以进行,反应的活化能高;
(2)根据图表中的平衡常数随温度变化趋势是,温度越高,K值越大;因反应在高温下能自发,所以△S>0;
Ⅲ、A是柠檬酸二氢钠(NaH2C6H5O7)溶液,H2C6H5O7-电离强于水解显酸性,pH小于7;B溶液是氰化钠和氢氰酸等浓度的混合溶液,CN-水解强于HCN的电离,溶液显碱性,pH大于7.
解答:
解:Ⅰ(1)氟化氢是共价化合物,纯液态时不电离,因而不导电,故不能通过电解纯净的液态HF获得F2;
阳极发生氧化反应,HF2-在阳极上放电,生成F2与H+,电极反应式为HF2--2e-=F2↑+H+,
故答案为:氟化氢是共价化合物,纯液态时不电离,因而不导电;HF2--2e-=F2↑+H+;
(2)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-,反应离子方程式为AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-,
故答案为:AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-;
Ⅱ.(1)闪电或者高温,主要是提供能量 给N2分子,让其破坏变成氮原子,因此,只能说明 引发反应所需要的能量高即活化能,不能说明反应吸收的能量高;故答案为:A;
(2)①在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K随温度升高K值增大,所以正反应方向是吸热反应,△H>0,因反应在高温下能自发,所以△S>0,故答案为:>;>;
Ⅲ.因为H2C6H5O7-电离强于水解显酸性,而CN-水解强于HCN的电离,溶液显碱性,
故答案为:<;A是柠檬酸二氢钠(NaH2C6H5O7)溶液,H2C6H5O7-电离强于水解显酸性,pH小于7;B溶液是氰化钠和氢氰酸等浓度的混合溶液,CN-水解强于HCN的电离,溶液显碱性,pH大于7.
阳极发生氧化反应,HF2-在阳极上放电,生成F2与H+,电极反应式为HF2--2e-=F2↑+H+,
故答案为:氟化氢是共价化合物,纯液态时不电离,因而不导电;HF2--2e-=F2↑+H+;
(2)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-,反应离子方程式为AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-,
故答案为:AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-;
Ⅱ.(1)闪电或者高温,主要是提供能量 给N2分子,让其破坏变成氮原子,因此,只能说明 引发反应所需要的能量高即活化能,不能说明反应吸收的能量高;故答案为:A;
(2)①在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K随温度升高K值增大,所以正反应方向是吸热反应,△H>0,因反应在高温下能自发,所以△S>0,故答案为:>;>;
Ⅲ.因为H2C6H5O7-电离强于水解显酸性,而CN-水解强于HCN的电离,溶液显碱性,
故答案为:<;A是柠檬酸二氢钠(NaH2C6H5O7)溶液,H2C6H5O7-电离强于水解显酸性,pH小于7;B溶液是氰化钠和氢氰酸等浓度的混合溶液,CN-水解强于HCN的电离,溶液显碱性,pH大于7.
点评:本题考查化学平衡常数的含义、读图获取信息能力等,难度中等,需要学生具备扎实的基础与灵活运用知识分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关物质的分类正确的是( )
| A、石油、煤、小苏打都是混合物 |
| B、烧碱、纯碱、碱石灰都是碱 |
| C、HNO3、NaOH、NaNO3都是电解质 |
| D、HCl、H2SO4、NaOH都是离子化合物 |
 实验室常用如图所示的两套装置测量所制得气体的体积,下面有关这两套量气装置的使用说明有错误的是( )
实验室常用如图所示的两套装置测量所制得气体的体积,下面有关这两套量气装置的使用说明有错误的是( )| A、使用A装置量气前,其右管中应充满相应的液体 |
| B、量气前,B装置中广口瓶通常应盛满相应的液体 |
| C、A装置收集完气体后,在读数前应使盛液管内液面与集气管内液面相平 |
| D、A装置是直接测量气体体积,而B装置直接测量的是所排出液体的体积 |
 A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.
A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.