题目内容
某硫酸厂用接触法制硫酸:
(1)在煅烧黄铁矿时损失硫5%(质量分数,下同);在SO2的催化氧化时,SO3的产率为92%;在吸收塔中损失SO30.6%.现有含FeS295%的黄铁矿(杂质不含硫元素)100t,可制得98%的浓硫酸 t.
(2)若该厂每小时生产a t98%(质量分数)硫酸.为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%.若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则该厂每小时消耗标准状况下空气的体积为 m3,b%的下限等于 .
(3)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐.为测定此铵盐中氮元素的质量分数,将不同质量的铵盐样品分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.部分测定结果如下:
①铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同;
②铵盐质量为30.000g时,浓硫酸质量增重0.680g;
③铵盐质量为40.000g时,浓硫酸的质量不变.
通过计算推理求解该铵盐的成分和铵盐样品中氮元素的质量分数.(写出计算推理过程,计算结果用小数表示,并保留3位小数)
(1)在煅烧黄铁矿时损失硫5%(质量分数,下同);在SO2的催化氧化时,SO3的产率为92%;在吸收塔中损失SO30.6%.现有含FeS295%的黄铁矿(杂质不含硫元素)100t,可制得98%的浓硫酸
(2)若该厂每小时生产a t98%(质量分数)硫酸.为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%.若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则该厂每小时消耗标准状况下空气的体积为
(3)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐.为测定此铵盐中氮元素的质量分数,将不同质量的铵盐样品分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.部分测定结果如下:
①铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同;
②铵盐质量为30.000g时,浓硫酸质量增重0.680g;
③铵盐质量为40.000g时,浓硫酸的质量不变.
通过计算推理求解该铵盐的成分和铵盐样品中氮元素的质量分数.(写出计算推理过程,计算结果用小数表示,并保留3位小数)
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:(1)根据硫元素守恒结合关系式:FeS2→2H2SO4来计算即可;
(2)根据硫元素守恒计算每小时生成硫酸的量以及每小时消耗空气的体积为,“b的下限”,其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应;
(3)铵盐和强碱之间反应会产生氨,浓硫酸吗质量的增加量即为生成氨气的量,根据氮元素守恒列方程组计算.
(2)根据硫元素守恒计算每小时生成硫酸的量以及每小时消耗空气的体积为,“b的下限”,其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应;
(3)铵盐和强碱之间反应会产生氨,浓硫酸吗质量的增加量即为生成氨气的量,根据氮元素守恒列方程组计算.
解答:
解:(1)设可制得98%的硫酸的质量为xt.
由关系式
FeS2→2H2SO4
120 2×98
100×95%×(1-5%)×92%×(1-0.6%) x?98%
120:[100×95%×(1-5%)×92%×(1-0.6%)]=2×98:x?98%,x=137.55(t),
故答案为:137.55;
(2)由S守恒,每小时生成:
n(S)=n(SO2)=n(SO3)=n(H2SO4)=(a×106×98%)÷98=a×104mol.
设每小时消耗空气的体积为V.
则由S+O2
SO2,n(燃烧耗O2)=n(SO2),且气体体积不变,据此可得以下关系:
空气中O2的体积=燃烧耗O2的体积+燃烧后混合气体中O2的体积,
即V×21%=a×104×22.4×10-3+V×b%,解得V=
,“b的下限”,其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应.
因S+O2
SO2和O2+2SO2
2SO3两步反应耗O2(空气)之比为2:1,
故燃烧后(第一步反应后)混合气体中O2的体积分数的下限是b%=
×21%=7%,
故答案为:
;7%;
(3)设50.00mLNaOH溶液含有NaOH为amol,10.000 g混合盐完全反应,假设其中NH4HSO4为xmol,(NH4)2SO4为ymol.
则有:
115x+132y=0
x+2y=a-2x
a-3x=
解得:a=0.232
x=0.064
y=0.02(3分)
假设成立,该铵盐的成分为NH4HSO4和(NH4)2SO4.
该铵盐样品中氮元素的质量分数=
×100%=14.6%,
答:该铵盐的成分为NH4HSO4和(NH4)2SO4,铵盐样品中氮元素的质量分数为14.6%.
由关系式
FeS2→2H2SO4
120 2×98
100×95%×(1-5%)×92%×(1-0.6%) x?98%
120:[100×95%×(1-5%)×92%×(1-0.6%)]=2×98:x?98%,x=137.55(t),
故答案为:137.55;
(2)由S守恒,每小时生成:
n(S)=n(SO2)=n(SO3)=n(H2SO4)=(a×106×98%)÷98=a×104mol.
设每小时消耗空气的体积为V.
则由S+O2
| ||
空气中O2的体积=燃烧耗O2的体积+燃烧后混合气体中O2的体积,
即V×21%=a×104×22.4×10-3+V×b%,解得V=
| 22400a |
| 21-b |
因S+O2
| ||
| 催化剂 |
| △ |
故燃烧后(第一步反应后)混合气体中O2的体积分数的下限是b%=
| 1 |
| 2+1 |
故答案为:
| 22400a |
| 21-b |
(3)设50.00mLNaOH溶液含有NaOH为amol,10.000 g混合盐完全反应,假设其中NH4HSO4为xmol,(NH4)2SO4为ymol.
则有:
115x+132y=0
x+2y=a-2x
a-3x=
| 0.68 |
| 17 |
解得:a=0.232
x=0.064
y=0.02(3分)
假设成立,该铵盐的成分为NH4HSO4和(NH4)2SO4.
该铵盐样品中氮元素的质量分数=
| (0.064+2×0.020)×14 |
| 10.000 |
答:该铵盐的成分为NH4HSO4和(NH4)2SO4,铵盐样品中氮元素的质量分数为14.6%.
点评:本题涉及有关化学方程式的计算,注意守恒思想在解题中的应用是关键,难度中等.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列分子的中心原子未采用sp3杂化的是( )
| A、H2O |
| B、NH3 |
| C、CH2Cl2 |
| D、CH2O |
下列说法不正确的是( )
| A、“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
| B、蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质 |
| C、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D、离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 |
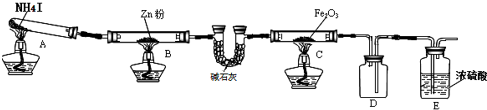
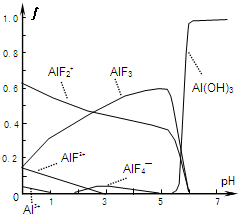 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是