题目内容
在常温下,下列物种溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4④0.1mol/LNH3.H2O和0.1mol/LNH4Cl⑤0.1mol/LNH3.H2O
(1)溶液①呈 性(填“酸”、“中”、“碱”),其原因是(用离子方程式表示)
(2)常温下,测得②的pH=7,则说明CH3COO-的水解程度 NH4+的水解程度 (填“>”“<”“=”,下同),CH3COO-与NH4+浓度的大小关系是c(CH3COO-) c(NH4+)
(3)在上述五种溶液中,pH最小的是 ;c(NH4+)最大的是 (填序号)
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4④0.1mol/LNH3.H2O和0.1mol/LNH4Cl⑤0.1mol/LNH3.H2O
(1)溶液①呈
(2)常温下,测得②的pH=7,则说明CH3COO-的水解程度
(3)在上述五种溶液中,pH最小的是
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:盐类的水解专题
分析:(1)铵根离子水解显示酸性;
(2)常温下,溶液的pH=7,显示中性,则氢离子和氢氧根浓度相等,根据电荷守恒确定离子浓度大小的关系;
(3)溶液酸性越强,氢离子浓度越大,pH越小,根据铵根离子的水解的影响情况确定铵根离子浓度大小.
(2)常温下,溶液的pH=7,显示中性,则氢离子和氢氧根浓度相等,根据电荷守恒确定离子浓度大小的关系;
(3)溶液酸性越强,氢离子浓度越大,pH越小,根据铵根离子的水解的影响情况确定铵根离子浓度大小.
解答:
解:(1)氯化铵为强酸弱碱盐,铵根离子水解,导致溶液显示酸性,即NH4++H2O?NH3.H2O+H+,故答案为:酸;NH4++H2O?NH3.H2O+H+;
(2)常温下,醋酸铵溶液中醋酸跟水解显示碱性,铵根离子水解显示酸性,溶液的pH=7,显示中性,则醋酸根离子和铵根离子水解程度相等,根据电荷守恒得c(CH3COO-)=c(NH4+),故答案为:=;=;
(3)①0.1mol/L NH4Cl中铵根离子浓度小于0.1mol/L;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;
③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,小于0.1mol/L,溶液呈酸性;
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;
⑤0.1mol/L NH3?H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;所以溶液PH最小的是③,铵根离子浓度最大的是④;
故答案为:③;④.
(2)常温下,醋酸铵溶液中醋酸跟水解显示碱性,铵根离子水解显示酸性,溶液的pH=7,显示中性,则醋酸根离子和铵根离子水解程度相等,根据电荷守恒得c(CH3COO-)=c(NH4+),故答案为:=;=;
(3)①0.1mol/L NH4Cl中铵根离子浓度小于0.1mol/L;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于①;
③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于①,小于0.1mol/L,溶液呈酸性;
④0.1mol/L NH3?H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;
⑤0.1mol/L NH3?H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;所以溶液PH最小的是③,铵根离子浓度最大的是④;
故答案为:③;④.
点评:本题考查了盐类水解和弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,知道常见弱电解质、盐的性质是解本题关键,知道弱酸酸性强弱与酸根离子水解程度关系,注意硫酸氢铵电离方式,题目难度不大.

练习册系列答案
相关题目
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1)
下列说法不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A、c1=c2 |
| B、a+b=92.4 |
| C、2p2=p3 |
| D、α2>α3 |
下列关于氯及其化合物的说法正确的是( )
| A、钠在Cl2中燃烧,产生大量黄烟 |
| B、HClO是弱酸,所以NaCIO是弱电解质 |
| C、Cl2通入H2S饱和溶液中出现浑浊,说明氧化性:Cl2>S |
| D、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
a、b、m三种金属片,把a、b用导线连接后同时浸入稀硫酸溶液中,a是负极,把b、m用导线连接后同时浸入稀硫酸溶液中,b发生氧化反应,三种金属的活动性顺序是( )
| A、b>a>m |
| B、m>b>a |
| C、a>m>b |
| D、a>b>m |
在恒温恒容的某密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g),下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
| 高温 |
| A、体系的压强不再发生变化 |
| B、生成nmolCO的同时生成n molH2 |
| C、v正(CO)=v逆(H2O) |
| D、1molH-H键断裂的同时2molH-O键断裂 |
下列过程需要通电后才可以发生或进行的是( )
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
| A、①② | B、②③④ |
| C、②③④⑤ | D、全部 |
下列说法正确的是( )
| A、Na2O2、Na2O均能吸收CO2并放出氧气 |
| B、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| C、Na比Cu活泼,将Na投入CuSO4溶液中会有铜析出 |
| D、从lL lmol?L-1的H2SO4溶液中取出10 mL,其中H+浓度为2mol?L-1 |
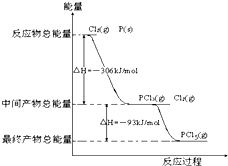 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题: