题目内容
下列叙述正确的是( )
| A、盐酸中滴加氨水至中性,溶质为氯化铵 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C、饱和石灰水中加入少量CaO,恢复至原温后溶液的pH值不变 |
| D、向沸水中滴加适量饱和FeCl3溶液,可制得红褐色带电的胶体 |
考点:弱电解质在水溶液中的电离平衡,胶体的重要性质,酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、当盐酸和氨水恰好中和生成NH4Cl时,铵根离子水解呈酸性;
B、醋酸是弱电解质,加水稀释促进电离,平衡状态下离子浓度减小;
C、饱和石灰水中加入氧化钙会与水反应生成氢氧化钙,析出晶体后溶液仍是饱和溶液离子浓度不变;
D、胶体是电中性的分散系.
B、醋酸是弱电解质,加水稀释促进电离,平衡状态下离子浓度减小;
C、饱和石灰水中加入氧化钙会与水反应生成氢氧化钙,析出晶体后溶液仍是饱和溶液离子浓度不变;
D、胶体是电中性的分散系.
解答:
解:A、当盐酸和氨水恰好中和生成NH4Cl时,由于铵根离子水解呈酸性,若使溶液呈中性,应继续向溶液中加入氨水,故溶液中的溶质是NH4Cl和NH3?H2O,故A错误;
B、向稀醋酸中加水时,醋酸的电离平衡正向移动,醋酸的电离程度增大,但c(H+)减小,故pH增大,故B错误;
C、温度不变,Ca(OH)2的溶解度不发生变化,故饱和石灰水中c(OH-)的浓度不变,所以pH不变,故C正确;
D、氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,不带电,故D错误;
故选C.
B、向稀醋酸中加水时,醋酸的电离平衡正向移动,醋酸的电离程度增大,但c(H+)减小,故pH增大,故B错误;
C、温度不变,Ca(OH)2的溶解度不发生变化,故饱和石灰水中c(OH-)的浓度不变,所以pH不变,故C正确;
D、氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,不带电,故D错误;
故选C.
点评:本题考查了酸碱反应的溶液酸碱性判断,弱电解质稀释溶液PH变化,饱和溶液的离子浓度分析,胶体性质的应用,题目难度中等.

练习册系列答案
相关题目
下列分离和提纯的实验,所选用的方法不正确的是( )
| 序号 | A | B | C | D |
| 实验目的 | NaOH溶液与泥沙分离 | 从浓食盐水中得到氯化钠晶体 | 提纯碘水中的I2 | 分离乙醇与水 |
| 分离方法 | 过滤 | 蒸馏 | 萃取、分液 | 蒸馏 |
| A、A | B、B | C、C | D、D |
a、b、m三种金属片,把a、b用导线连接后同时浸入稀硫酸溶液中,a是负极,把b、m用导线连接后同时浸入稀硫酸溶液中,b发生氧化反应,三种金属的活动性顺序是( )
| A、b>a>m |
| B、m>b>a |
| C、a>m>b |
| D、a>b>m |
0.1mol/L氨水和0.1mol/L盐酸等体积混合后,溶液中离子浓度大小顺序正确的是( )
| A、c(Cl-)>c(H-)>c(NH4+)>c(OH-) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(Cl-)>c(OH-)>c(NH4+)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
下列过程需要通电后才可以发生或进行的是( )
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀.
| A、①② | B、②③④ |
| C、②③④⑤ | D、全部 |
升高温度,下来物理量不一定增大的是( )
| A、化学反应中的反应速率 |
| B、水的离子积常数 |
| C、化学平衡常数 |
| D、弱酸的电离平衡常数 |
关于下列装置说法正确的是( )
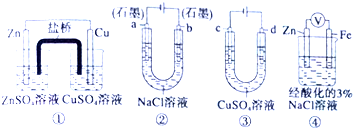

| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、用装置③精炼铜时,c极为粗铜 |
| C、装置②工作一段时间后,a极附近溶液的pH增大 |
| D、装置④中电子Zn流向Fe,装置中有Fe2+生成 |
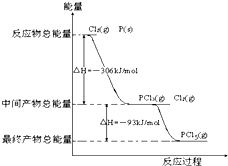 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题: