题目内容
一定温度下的密闭容器中存在如下反应:H2(g)+I2(g)?2HI
已知氢气的起始浓度为0.4mol/L,碘蒸气的起始浓度为1mol/L,经测定,该反应在该温度下的平衡常数K=64,试判断:
(1)当氢气转化率为50%时,该反应是否达到平衡状态,若未达到,正向哪个反应进行?
(2)达到平衡状态时,请问氢气转化率应为多少?
已知氢气的起始浓度为0.4mol/L,碘蒸气的起始浓度为1mol/L,经测定,该反应在该温度下的平衡常数K=64,试判断:
(1)当氢气转化率为50%时,该反应是否达到平衡状态,若未达到,正向哪个反应进行?
(2)达到平衡状态时,请问氢气转化率应为多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)依据化学平衡三段式列式计算氢气转化率50%时隔物质浓度,计算浓度商Q和平衡常数比较分析判断反应进行方向;
(2)结合三段式列式,依据平衡常数计算;
(2)结合三段式列式,依据平衡常数计算;
解答:
解:(1)依据三段式列式计算,当氢气转化率为50%时反应的氢气浓度为0.2mol/L;
H2 +I2 =2HI(g)
起始量(mol/L) 0.4 1 0
变化量(mol/L) 0.2 0.2 0.4
某时刻(mol/L) 0.2 0.8 0.4
Q=
=1<K=64,反应未达到平衡状态,则反应正向进行;
答:当氢气转化率为50%时,该反应是未达到平衡状态,反应向正反应方向进行;
(2)依据三段式列式计算,平衡时氢气转化浓度x;
H2 +I2 =2HI(g)
起始量(mol/L) 0.4 1 0
变化量(mol/L) x x 2x
平衡量(mol/L) 0.4-x 1-x 2x
K=
=64
x≈0.38mol/L;
氢气转化率=
×100%=96.3%
答:氢气转化率应96.3%;
H2 +I2 =2HI(g)
起始量(mol/L) 0.4 1 0
变化量(mol/L) 0.2 0.2 0.4
某时刻(mol/L) 0.2 0.8 0.4
Q=
| 0.42 |
| 0.2×0.8 |
答:当氢气转化率为50%时,该反应是未达到平衡状态,反应向正反应方向进行;
(2)依据三段式列式计算,平衡时氢气转化浓度x;
H2 +I2 =2HI(g)
起始量(mol/L) 0.4 1 0
变化量(mol/L) x x 2x
平衡量(mol/L) 0.4-x 1-x 2x
K=
| 4x2 |
| (0.4-x)(1-x) |
x≈0.38mol/L;
氢气转化率=
| 0.38mol/L |
| 0.4mol/L |
答:氢气转化率应96.3%;
点评:本题考查化学平衡的计算,题目难度不大,注意平衡常数的定义和应用.

练习册系列答案
相关题目
下列关于糖类的说法正确的是( )
| A、所有糖类物质都有甜味,但不一定都溶于水 |
| B、葡萄糖和果糖性质不同,但分子式相同 |
| C、葡萄糖和蔗糖不是同分异构体,但属于同系物 |
| D、葡萄糖、果糖和蔗糖都能发生水解反应 |
为逐一分离试样X中的Na+、Ba2+、Cu2+、Ag+等四种阳离子,对该试样进行的实验设计如下:
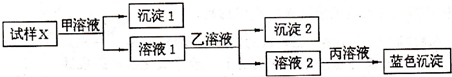
有关甲、乙、丙的选择有以下四种方案:
①H2SO4、HCl、NaOH;②NaCl、Na2SO4、NaOH;③NaCl、Na2CO3、NaOH;④HCl、H2SO4、NaOH.
能达到实验目的是( )

有关甲、乙、丙的选择有以下四种方案:
①H2SO4、HCl、NaOH;②NaCl、Na2SO4、NaOH;③NaCl、Na2CO3、NaOH;④HCl、H2SO4、NaOH.
能达到实验目的是( )
| A、①③ | B、①④ | C、②③ | D、②④ |
向一定量的铁铝合金加入足量的稀盐酸,充分反应后,生成标况下的H2672mL,将等量的合金投入到足量的稀硝酸中,完全反应后,被还原的HNO3的物质的量为(假设还原产物是NO)( )
| A、0.03mol |
| B、0.02mol |
| C、大于0.02mol |
| D、小于0.02mol |
下列说法中不正确的是( )
| A、汽油和水、CCl4和水两组物质,都能用分液漏斗进行分离 |
| B、在1L 5.0mol/L HCl溶液中取出了10 mL,取出的HCl溶液其浓度为5.0 mol/L |
| C、分散系根据分散质粒子大小可分为溶液、胶体、浊液 |
| D、0.5 molCuO的摩尔质量为40g/mol |
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是( )
| A、240 mL 0.2 mol?L-1的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器 |
| B、向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体 |
| C、不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗 |
| D、用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出 |
 化合物A,B可合成荧光“魔棒”中产生能量的物质之一 (CPPO).请回答:
化合物A,B可合成荧光“魔棒”中产生能量的物质之一 (CPPO).请回答: