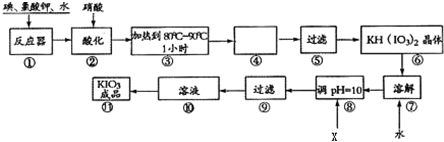
题目内容
为逐一分离试样X中的Na+、Ba2+、Cu2+、Ag+等四种阳离子,对该试样进行的实验设计如下:
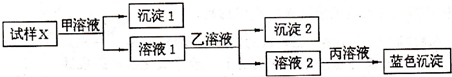
有关甲、乙、丙的选择有以下四种方案:
①H2SO4、HCl、NaOH;②NaCl、Na2SO4、NaOH;③NaCl、Na2CO3、NaOH;④HCl、H2SO4、NaOH.
能达到实验目的是( )

有关甲、乙、丙的选择有以下四种方案:
①H2SO4、HCl、NaOH;②NaCl、Na2SO4、NaOH;③NaCl、Na2CO3、NaOH;④HCl、H2SO4、NaOH.
能达到实验目的是( )
| A、①③ | B、①④ | C、②③ | D、②④ |
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:如先加硫酸或硫酸钠,则同时生成硫酸钡和硫酸银沉淀,则应先加入盐酸或氯化钠,生成氯化银沉淀,过滤后在滤液中加入硫酸或硫酸钠生成硫酸钡沉淀,最后加入氢氧化钠溶液可生成氢氧化铜沉淀,以此解答该题.
解答:
解:①先加硫酸或硫酸钠,则同时生成硫酸钡和硫酸银沉淀,故错误;
②先加入氯化钠,生成氯化银沉淀,过滤后在滤液中加入硫酸钠生成硫酸钡沉淀,最后加入氢氧化钠溶液可生成氢氧化铜沉淀,故正确;
③加入碳酸钠和同时生成碳酸钡和碳酸铜沉淀,故错误;
④先加入盐酸,生成氯化银沉淀,过滤后在滤液中加入硫酸生成硫酸钡沉淀,最后加入氢氧化钠溶液可生成氢氧化铜沉淀,故正确.
故选D.
②先加入氯化钠,生成氯化银沉淀,过滤后在滤液中加入硫酸钠生成硫酸钡沉淀,最后加入氢氧化钠溶液可生成氢氧化铜沉淀,故正确;
③加入碳酸钠和同时生成碳酸钡和碳酸铜沉淀,故错误;
④先加入盐酸,生成氯化银沉淀,过滤后在滤液中加入硫酸生成硫酸钡沉淀,最后加入氢氧化钠溶液可生成氢氧化铜沉淀,故正确.
故选D.
点评:本题考查实验方案的设计,为高频考点,侧重于学生的分析能力和实验能力的考查,对同一个化学实验,可设计出多种实验方案,并应对它们作出合理的评价与选择.题目要求“逐一分离”,因此可考虑离子间的相互反应情况,若同时生成多种沉淀,则说明该方案不可行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验室用MnO2和浓盐酸制氯气时,有14.6g HCl被氧化,所得氯气全部用石灰乳吸收,可制得漂白精的质量是( )
| A、14.3g |
| B、25.4g |
| C、28.6g |
| D、50.8g |
5.12克铜和一定质量的硝酸反应,当铜消耗完时,共收集到标准状况下的气体3.36升,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下的氧气才能使集气瓶充满溶液.( )
| A、0.336升 |
| B、0.224升 |
| C、0.896升 |
| D、1.12升 |
一块表面已被氧化为氧化钠的钠块5.4g,投入50g水中,最多能产生0.10g气体,则原来被氧化的钠是( )
| A、2.3g | B、3.1g |
| C、4.6g | D、5.3g |