题目内容
15.【物质结构与性质】A2-和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子.
请回答下列问题:
(1)基态F原子的核外电子排布式为1s22s22p63s23p33d104s1(或[Ar]3d104s1),F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为
 .
.(2)六种元素中电负性最小的是Na,其中C、D、E的第一电离能由大到小顺序为Cl>P>S(填元素符号).
(3)A、B 的氢化物所属的晶体类型分别为分子晶体、离子晶体.
(4)指出A、D的简单氢化物中沸点较高的物质并说明原因H2O,水分子间能形成氢键.
(5)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为三角锥形,中心原子的杂化轨道类型为sp3.
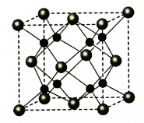
(6)A和B能够形成化合物Y,其晶胞结构如图所示,晶胞参数为a nm,Y的化学式为Na2O,列式计算晶体Y的密度(可不化简)$\frac{\frac{62}{{N}_{A}}×4}{(a×1{0}^{-7})^{3}}$g•cm-3.
分析 A、B、C、D、E、F为原子序数依次增大的前四周期六种元素,C核外电子总数是最外层电子数的3倍,应为P元素,C、E为同周期元素,则应为第三周期元素,E元素最外层有一个未成对电子,应为Cl元素,则D为S元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素,F的最外层只有1个电子,但次外层有18个电子,F为Cu元素,以此解答该题.
解答 解:A、B、C、D、E、F为原子序数依次增大的前四周期六种元素,C核外电子总数是最外层电子数的3倍,应为P元素,C、E为同周期元素,则应为第三周期元素,E元素最外层有一个未成对电子,应为Cl元素,则D为S元素,A2-和B+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Na元素,F的最外层只有1个电子,但次外层有18个电子,F为Cu元素,
(1)F为Cu,原子序数为29,电子排布为1s22s22p63s23p33d104s1 (或[Ar]3d104s1),与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为 ,
,
故答案为:1s22s22p63s23p33d104s1 (或[Ar]3d104s1); ;
;
(2)六种元素中电负性最小的是 Na,同周期自左而右第一电离能呈增大趋势,但P元素3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Cl>P>S,
故答案为:Na; Cl>P>S;
(3)A、B 的氢化物分别为水、NaH,所属的晶体类型分别为分子晶体、离子晶体,故答案为:分子晶体、离子晶体;
(4)水含有氢键,沸点较高,而硫化氢不含氢键,常温下为气体,沸点比水的低,故答案为:H2O,水分子间能形成氢键;
(5)C和D反应可生成组成比为1:3的化合物为PCl3,P形成3个δ键,孤电子对数为$\frac{5-3×1}{2}$=1,则为sp3杂化,立体构型为为三角锥形,
故答案为:三角锥形;sp3;
(6)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
N(Na):N(O)=2:1,则形成的化合物为Na2O,
晶胞的质量为$\frac{62}{{N}_{A}}×4$,
晶胞的体积为(a×10-7)cm3,
则晶体F的密度为$\frac{\frac{62}{{N}_{A}}×4}{(a×1{0}^{-7})^{3}}$g•cm-3,
故答案为:Na2O;$\frac{\frac{62}{{N}_{A}}×4}{(a×1{0}^{-7})^{3}}$.
点评 本题考查物质结构和性质,为高频考点和常见题型,侧重考查学生空间想象能力、知识运用能力,涉及晶胞计算、原子结构等知识点,综合性较强,采用均摊法、价层电子对互斥理论等理论分析解答,题目难度中等.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | 物质的量浓度 | B. | 溶质的物质的量 | C. | 溶液的体积 | D. | 质量分数 |
| A. | 对废气、废水、废渣进行严格处理 | |
| B. | 在化工生产中少用或不用有害物质以及少排放或不排放有害物质 | |
| C. | 在化工生产中,不使用任何化学物质 | |
| D. | 在化工厂种草种树,使其成为花园式工厂 |
| A. | 容量瓶 | B. | 胶头滴管 | C. | 烧瓶 | D. | 玻璃棒 |
| A. | Y和W的含氧酸均为强酸 | |
| B. | YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形 | |
| C. | 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 | |
| D. | 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |

| A. | 分子中所有的原子共平面 | |
| B. | 既可以使溴水褪色.又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 1 mol该化合物最多可以与9mol H2发生加成反应 | |
| D. | 该物质能发生取代反应、氧化反应、加成反应 |
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 反应CN-+H2O+CO2═HCN+HCO3-能够发生 | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-{c(HCOO-)}<c(K+)-c(CN-) | |
| D. | c(NH4+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
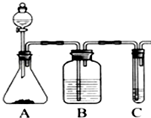 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.