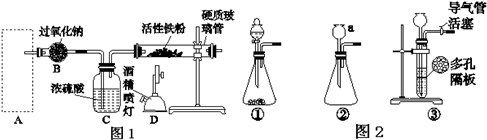
题目内容
10.短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2.下列说法中正确的是( )| A. | Y和W的含氧酸均为强酸 | |
| B. | YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形 | |
| C. | 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 | |
| D. | 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
分析 短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,四元素原子最外层电子数分别为1、3、5、7中的一个,Z是金属元素,最外层电子数不超过3,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,则X、Y、W原子最外层电子数为1、5、7,则Z为Al,其最外层电子数为3,而X与W的最高化合价之和为8,则Y原子最外层电子数为5,且Y的原子序数小于Al,故Y为N元素;W原子序数大于Al,最外层电子数只能为7,故W为Cl,X的最外层电子数为1,则X为H或Li.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,四元素原子最外层电子数分别为1、3、5、7中的一个,Z是金属元素,最外层电子数不超过3,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,则X、Y、W原子最外层电子数为1、5、7,则Z为Al,其最外层电子数为3,而X与W的最高化合价之和为8,则Y原子最外层电子数为5,且Y的原子序数小于Al,故Y为N元素;W原子序数大于Al,最外层电子数只能为7,故W为Cl,X的最外层电子数为1,则X为H或Li.
A.Y和W的最高价含氧酸均为强酸,不是最高价含氧酸时,含氧酸不一定是强酸,故A错误;
B.NCl3分子中N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,N原子的杂化方式为sp3,分子的空间构型为三角锥形,故B错误;
C.由非金属元素组成的化合物YX5为NH4H,与水反应必然生成气体H2和一水合氨,一水合氨为弱碱,故C正确;
D.Z与W的化合物为氯化铝,属于共价化合物,熔融状态下不导电,Z的氧化物为氧化铝,属于离子化合物,熔点很高,工业上常用电解氧化铝的方法制取单质铝,故D错误.
故选C.
点评 本题考查原子结构与元素周期律的关系,注意根据最外层电子数为奇数推断元素,侧重考查学生分析推理能力与知识迁移运用,题目难度中等.

| A. | 标准状况下,40gSO3的体积约为11.2L | |
| B. | 硫粉在过量的纯氧中燃烧生成SO3 | |
| C. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铜锌原电池工作时,电子从铜电极流向锌电极 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 锌锰干电池中,锌电极是负极 |
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法不正确的是( )
| A. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 | |
| B. | 湿法中FeO42-是氧化产物;干法中O2也是氧化产物 | |
| C. | 干法中每生成1mol Na2FeO4,这个反应共转移4mol电子 | |
| D. | 高铁酸钠中铁显+6价,它在氧化还原反应中通常被还原 |
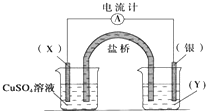 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: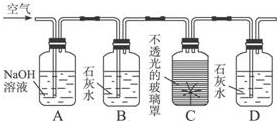
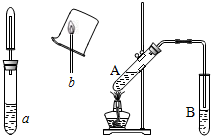 乙醇性质探究
乙醇性质探究
 .
.