题目内容
16.(1)将106g Na2CO3固体溶于1L水配成溶液,(2)将1molNa2CO3•10H2O溶于水配成1L溶液.两份溶液相比,下列量一定相等的是( )| A. | 物质的量浓度 | B. | 溶质的物质的量 | C. | 溶液的体积 | D. | 质量分数 |
分析 (1)将106g Na2CO3固体溶于1L水配成溶液混合后溶液的体积大于1L,(2)将1molNa2CO3•10H2O溶于水配成1L溶液.两份溶液相比,(1)体积较大,(2)质量分数较大,由此分析解答.
解答 解:(1)将106g Na2CO3固体溶于1L水配成溶液混合后溶液的体积大于1L,(2)将1molNa2CO3•10H2O溶于水配成1L溶液.两份溶液相比,(1)体积较大,(2)质量分数较大,但两者的物质的量相等,故选B.
点评 本题考查了物质的量浓度概念的分析判断,主要是溶液体积的理解,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
6.关于以下物质熔点比较正确的是( )
| A. | NaCl>BaCl2>金刚石>S>Hg | B. | 金刚石>BaCl2>NaCl>S>Hg | ||
| C. | 金刚石>NaCl>BaCl2>S>Hg | D. | 金刚石>BaCl2>NaCl>Hg>S |
7.元素周期律揭示了元素间的递变规律,下列说法正确的是( )
| A. | VIIA族元素的非金属性:F>Cl,所以VIIA族元素氢化物的酸性:HF>HCl | |
| B. | 第二周期元素氢化物稳定性:HF>H2O,所以第三周期元素氢化物稳定性:HCl>H2S | |
| C. | 第二周期主族元素最外层电子数从1递增至7,所以第二周期主族元素的最高化合价也从+1递增至+7 | |
| D. | 工业制取金属钾的反应为:KCl (1)+Na (1)$\frac{\underline{\;850℃\;}}{\;}$NaCl(1)+K(g),所以金属性:Na>K |
4.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1L 1 mol•L-1的Fe2(SO4)3 溶液加热蒸干得到Fe(OH)3胶体粒子的数目为2NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64 g |
11.下列叙述中正确的是( )
| A. | 标准状况下,40gSO3的体积约为11.2L | |
| B. | 硫粉在过量的纯氧中燃烧生成SO3 | |
| C. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
8.粉笔具有吸附性,不同物质在粉笔表面具有不同的附着能力.用洁净的白粉笔、水进行层析实验,可以分离红、蓝墨水混合液中的染料.该实验的过程如图所示:
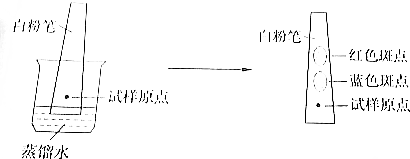
分析以上信息,可知该实验中蒸馏水( )

分析以上信息,可知该实验中蒸馏水( )
| A. | 是固定相 | B. | 是流动相 | ||
| C. | 是惰性支持物 | D. | 既是固定相,又是流动相 |
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
 .
.