题目内容
4.以下除杂方案不正确的是( )| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
分析 A.HCl极易溶于水,浓硫酸可干燥氯气;
B.氯化铵、铁离子均与NaOH溶液反应;
C.二氧化碳与NaOH溶液反应,而CO不能,浓硫酸可干燥CO;
D.碳酸氢钠加热分解生成碳酸钠.
解答 解:A.HCl极易溶于水,浓硫酸可干燥氯气,则依次通入盛有饱和食盐水、浓H2SO4的洗气瓶可除杂,故A正确;
B.氯化铵、铁离子均与NaOH溶液反应,不能除杂,应选择氨水、过滤可除杂,故B错误;
C.二氧化碳与NaOH溶液反应,而CO不能,浓硫酸可干燥CO,则依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶可除杂,故C正确;
D.碳酸氢钠加热分解生成碳酸钠,则用灼烧的方法除尽,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列能够说明醋酸是弱酸的是( )
| A. | 醋酸能与水以任意比例混溶 | B. | 醋酸能与碳酸钠反应 | ||
| C. | 醋酸能使紫色石蕊试液变红色 | D. | 0.1mol.L-1醋酸溶液pH=3 |
16.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60的形成的球碳盐K3C60.实验测知该物质属于离子晶体,具有良好的超导性.下列关于K3C60的组成和结构的分析中正确的是( )
| A. | K3C60的摩尔质量是837 | |
| B. | 1 mol K3C60中含有的离子数目为63×6.02×1023 | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式可写为KC20 |
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
 .
. ,B的结构简式
,B的结构简式
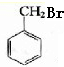 +H2O
+H2O
 .
.
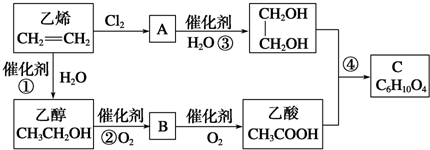
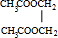 +2H2O.
+2H2O.