题目内容
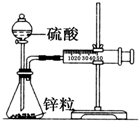 按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )
按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )| A、忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率0.01mol/(L?s) |
| B、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率0.01mol/(L?s) |
| C、用锌粒来表示10s内该反应的速率为0.013g/s |
| D、用H2来表示10s内该反应的速率为0.0002mol/s |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据生产氢气的体积计算消耗氢离子的物质的量、消耗锌的质量,
A.根据速率表达式计算以氢离子表示的反应速率;
B.再根据速率之比等于化学计量数之比判断;
C.根据速率单位选择计算方法;
D.根据速率单位选择计算方法.
A.根据速率表达式计算以氢离子表示的反应速率;
B.再根据速率之比等于化学计量数之比判断;
C.根据速率单位选择计算方法;
D.根据速率单位选择计算方法.
解答:
解:Zn+2H+=Zn2++H2↑
65g 1mol 1mol 22.4L
0.13g 0.004mol 0.002mol 0.0448L
A.v(H+)=
=0.01mol/(L?s),故A正确;
B.v(Zn2+)=
v(H+)=0.005mol/(L?s),故B错误;
C.用锌粒来表示10s内该反应的速率为
=0.013g/s,故C正确;
D.用H2来表示10s内该反应的速率为
=0.0002mol/s,故D正确;
故选B.
65g 1mol 1mol 22.4L
0.13g 0.004mol 0.002mol 0.0448L
A.v(H+)=
| ||
| 10s |
B.v(Zn2+)=
| 1 |
| 2 |
C.用锌粒来表示10s内该反应的速率为
| 0.13g |
| 10s |
D.用H2来表示10s内该反应的速率为
| ||
| 10s |
故选B.
点评:本题考查了反应速率的表示.注意速率可有不同的表示方法,常用单位时间内浓度变化表示.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
下列说法正确的是( )
| A、Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B、7.8gNa2O2与CO2完全反应,转移0.1 mol电子 |
| C、合金中至少含有两种金属元素 |
| D、NaHCO3、CaCO3、(NH4)2CO3三种固体受热后均能生成气体 |
Mg-AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源.电池的总反应可表示为:Mg+2AgCl═MgCl2+2Ag.下列关于该电池的说法错误的是( )
| A、该电池工作时,正极反应为:2AgCl+2e一═2C1一+2Ag |
| B、镁电极做该电池负极,负极反应为:Mg-2e一═Mg2+ |
| C、有24g Mg被氧化时,可还原得到108gAg |
| D、装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
分类是化学学习与研究的常用方法,下列分类正确的是( )
| A、Na2O、MgO、Al2O3均属于碱性氧化物 |
| B、石灰石、生石灰、熟石灰均属于碱 |
| C、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 |
下列有关判断、叙述正确的是( )
| A、质量分数为W的氨水其浓度为C1mol/L,则质量分数为2W的氨水,其浓度大于2C1 mol/L |
| B、3.2克的甲烷与标准状况下8.96 L的水所含有的氢原子数相同 |
| C、铅蓄电池中放电时转移2NA个电子,则电池内消耗4 mol H2SO4 |
| D、等质量的SO2与SO3所含有的氧原子数之比为5:6 |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,18g H2O含有10nA个电子 |
| B、等物质的量的H2和N2所含分子数均为NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1L0.1mol/L NH4Cl 溶液中含有NH4+数目为0.1NA |
往含Fe3+、H+、NO3-的混合液中加入少量含SO32-的某溶液充分反应后(设溶液中的其他成分不反应),下列表示该混合溶液中发生反应的离子方程式中正确的是( )
| A、2 Fe3++SO32-+H2O→2 Fe2++SO42-+2 H+ |
| B、2 H++SO32-→SO2↑+H2O |
| C、2 H++2 NO3-+3 SO32-→3 SO42-+2 NO+H2O |
| D、2 Fe3++3 SO32-+3 H2O→2 Fe(OH)3↓+3 SO2↑ |
下列有关摩尔质量的描述或应用中,不正确的是( )
A、1 mol NH
| ||
| B、SO2的摩尔质量为64 g?mol-1 | ||
| C、铝原子的摩尔质量等于它的相对原子质量 | ||
D、一个水分子的质量约等于
|