题目内容
下列说法正确的是( )
| A、Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B、7.8gNa2O2与CO2完全反应,转移0.1 mol电子 |
| C、合金中至少含有两种金属元素 |
| D、NaHCO3、CaCO3、(NH4)2CO3三种固体受热后均能生成气体 |
考点:钠的化学性质,合金的概念及其重要应用,钠的重要化合物
专题:元素及其化合物
分析:A.钠和水反应生成氢氧化钠和氢气,溶液呈碱性;
B.7.8gNa2O2的物质的量为0.1mol,结合方程式2Na2O2+2CO2=2Na2CO3+O2计算;
C.合金可以是金属与非金属的共熔物;
D.NaHCO3、CaCO3、(NH4)2CO3三种固体都不稳定,加热都可生成气体.
B.7.8gNa2O2的物质的量为0.1mol,结合方程式2Na2O2+2CO2=2Na2CO3+O2计算;
C.合金可以是金属与非金属的共熔物;
D.NaHCO3、CaCO3、(NH4)2CO3三种固体都不稳定,加热都可生成气体.
解答:
解:A.钠过量时,钠和水反应生成氢氧化钠和氢气,溶液呈碱性,而硫酸亚铁水解呈酸性,都不呈中性,故A错误;
B.7.8gNa2O2的物质的量为0.1mol,方程式为2Na2O2+2CO2=2Na2CO3+O2,由方程式可知,Na2O2中O元素化合价由-1价分别变为化为0价、-2价,2molNa2O2参加反应可转移2mol电子,则0.1mol8gNa2O2与CO2完全反应,转移0.1 mol电子,故B正确;
C.合金可以是金属与非金属的共熔物,如生铁,故C错误;
D.NaHCO3、CaCO3、(NH4)2CO3三种固体都不稳定,加热都可生成二氧化碳气体,故D正确.
故选BD.
B.7.8gNa2O2的物质的量为0.1mol,方程式为2Na2O2+2CO2=2Na2CO3+O2,由方程式可知,Na2O2中O元素化合价由-1价分别变为化为0价、-2价,2molNa2O2参加反应可转移2mol电子,则0.1mol8gNa2O2与CO2完全反应,转移0.1 mol电子,故B正确;
C.合金可以是金属与非金属的共熔物,如生铁,故C错误;
D.NaHCO3、CaCO3、(NH4)2CO3三种固体都不稳定,加热都可生成二氧化碳气体,故D正确.
故选BD.
点评:本题考查较为综合,涉及钠、过氧化钠、合金等知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度中等.

练习册系列答案
相关题目
下列各组固体物质中,在加水或加热的条件下,都能放出CO2的是( )
| A、NaHCO3和Al2(SO4)3 |
| B、NaHCO3和Na2CO3 |
| C、MgSO4和CaCO3 |
| D、Na2CO3和Al(NO3)3 |
以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图:
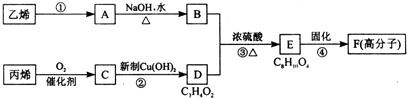
关于该过程的相关叙述正确的是( )

关于该过程的相关叙述正确的是( )
| A、反应④的反应类型是缩聚反应 |
| B、物质A是卤代烃 |
| C、物质B催化氧化后可以得到乙醛 |
| D、1 mol物质D最多可以消耗2 mol NaOH |
下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
| A、①②③④ | B、①和③ |
| C、③和④ | D、①和④ |
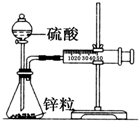 按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )
按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )| A、忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率0.01mol/(L?s) |
| B、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率0.01mol/(L?s) |
| C、用锌粒来表示10s内该反应的速率为0.013g/s |
| D、用H2来表示10s内该反应的速率为0.0002mol/s |
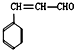 和化合物Ⅱ
和化合物Ⅱ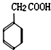 在一定条件下发生反应能生成化合物Ⅲ
在一定条件下发生反应能生成化合物Ⅲ ,请回答以下问题.
,请回答以下问题. )代替两个NH3与铂配位,则生成的产物
)代替两个NH3与铂配位,则生成的产物 和氯化钠溶液反应制取
和氯化钠溶液反应制取  的离子反应方程式
的离子反应方程式 )及呋喃(
)及呋喃( )形成的配合物[Pt(C4H4O)(C4H5N)Cl2],写出其结构简式
)形成的配合物[Pt(C4H4O)(C4H5N)Cl2],写出其结构简式