题目内容
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是( )
| A、加入NaOH(s) |
| B、加入盐酸 |
| C、加蒸馏水 |
| D、升高温度 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.加入NaOH,c(H+)减小;
B.加盐酸,氢离子浓度增大;
C.加水稀释氢离子浓度减小;
D.升高温度促进电离.
B.加盐酸,氢离子浓度增大;
C.加水稀释氢离子浓度减小;
D.升高温度促进电离.
解答:
解:A.加入烧碱溶液,反应生成CH3COO-,c(H+)减小,使电离平衡右移,故A不选;
B.加盐酸,氢离子浓度增大,但是电离平衡:CH3COOH?CH3COO-+H+左向移动,故B不选;
C.加水,溶液体积增大,导致氢离子、醋酸浓度都减小,电离平衡:CH3COOH?CH3COO-+H+右向移动,故C不选;
D.弱电解质的电离为吸热过程,加热促进电离,平衡右移,c(H+)增大,故D选.
故选D.
B.加盐酸,氢离子浓度增大,但是电离平衡:CH3COOH?CH3COO-+H+左向移动,故B不选;
C.加水,溶液体积增大,导致氢离子、醋酸浓度都减小,电离平衡:CH3COOH?CH3COO-+H+右向移动,故C不选;
D.弱电解质的电离为吸热过程,加热促进电离,平衡右移,c(H+)增大,故D选.
故选D.
点评:本题考查弱电解质的电离,侧重于考查学生的分析能力和化学基本概念的理解和应用能力,为高考常见题型,难度中等,注意把握影响弱电解质的电离的影响因素.

练习册系列答案
相关题目
盐酸、醋酸和碳酸氢钠是化学中的常见物质.下列表述正确的是( )
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C、CH3COOH溶液中加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、中和体积与pH值都相同的盐酸和醋酸溶液,所消耗NaOH的物质的量相同 |
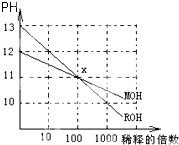 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )| A、等PH的MOH和ROH溶液,稀释相同倍数,ROH 溶液的PH略大 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、常温下pH之和为14的醋酸和ROH溶液等体积混合,溶液呈碱性 |
| D、在x点,c(M+)=c(R+) |
含 2molAlCl3的溶液与NaOH溶液反应得1mol沉淀,则消耗 NaOH可能是( )
| A、1 mol |
| B、3 mol |
| C、5 mol |
| D、7 mol |
下列说法正确的是( )
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | ||
| B、分子式为C4H7ClO2可与NaHCO3产生CO2,可能结构有3种 | ||
C、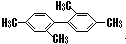 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | ||
D、用
|



