题目内容
表面被氧化的铝片溶于过量氢氧化钠溶液:
化学方程式:① ;② ;
离子方程式:① ;② .
化学方程式:①
离子方程式:①
考点:镁、铝的重要化合物,铝的化学性质
专题:几种重要的金属及其化合物
分析:根据氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,金属铝能和强碱反应生成氢气,结合方程式书写方法解答.
解答:
解:铝为活泼金属,表面被氧化的铝片含有氧化铝,溶于过量氢氧化钠溶液,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,反应的离子方程式为 Al2O3+2OH-═2AlO2-+H2O;
金属铝能和强碱反应化学方程式为:2Al+2NaOH+6H2O=2NaAl(OH)4+3H2↑;反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;Al2O3+2OH-═2AlO2-+H2O;2Al+2NaOH+6H2O=2NaAl(OH)4+3H2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;
金属铝能和强碱反应化学方程式为:2Al+2NaOH+6H2O=2NaAl(OH)4+3H2↑;反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;Al2O3+2OH-═2AlO2-+H2O;2Al+2NaOH+6H2O=2NaAl(OH)4+3H2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;
点评:本题考查离子反应方程式及化学反应方程式的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,注意反应物与生成物的分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、混合酸中NO3-物质的量为2mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、混合酸中H2SO4 的物质的量的浓度为2.5mol |
将足量的CO2气体通入下列澄清溶液中,最终仍为澄清溶液的是( )
| A、偏铝酸钠溶液 |
| B、氯化钡溶液 |
| C、水玻璃 |
| D、饱和Na2CO3溶液 |
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是( )
| A、加入NaOH(s) |
| B、加入盐酸 |
| C、加蒸馏水 |
| D、升高温度 |
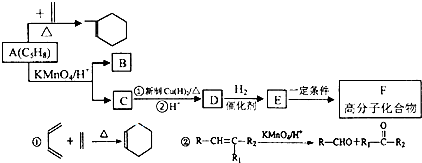
 时,A发生的反应类型为
时,A发生的反应类型为