题目内容
4.下列有关物质的保存方法不正确的是( )| A. | 浓氨水、浓硝酸应保存在棕色试剂瓶中,并置于阴凉处 | |
| B. | 液溴易挥发,应保存在棕色试剂瓶中,并加水封 | |
| C. | 在储存铵态化肥时,应密封包装并放在阴凉通风处 | |
| D. | 碘易升华,应保存在棕色细口瓶中,并置于阴凉处 |
分析 A、浓氨水、浓硝酸均见光易分解;
B、液溴易挥发,溴在水中溶解度较小,可以使用水封保存;
C、铵盐具有不稳定性;
D、碘易升华,应低温保存.
解答 解:A、浓氨水、浓硝酸均见光易分解,故应保存在棕色试剂瓶中,并避光保存,故A正确;
B、液溴具有挥发性,溴的密度大于水且在水中溶解度较小,所以保存液溴时应该放在棕色细口瓶中,并使用水封,故B正确;
C、铵盐都具有不稳定性,受热易分解,所以贮存铵态氮肥时要密封保存,并放在阴凉通风处,故C正确;
D、碘易升华,应低温保存,且为固体,故保存在棕色广口瓶中,故D错误.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析、实验能力的考查,注意常见物质的性质以及保存方法,难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
10.将表面有氧化膜的铝片伸入足量的NaOH溶液中,有关离子方程式正确的是( )
| A. | Al2O3+OH-→AlO2-+H2O | B. | 2Al3++6OH-→2Al(OH)3↓ | ||
| C. | 2Al+2OH-+2H2O→2AlO2-+3H2↑ | D. | 2Al+6H2O→2Al3++6OH-+3H2↑ |
15.下列说法正确的是 ( )
| A. | 强电解质溶液一定比弱电解质溶液的导电性强 | |
| B. | 强电解质的稀溶液中不存在溶质分子 | |
| C. | 弱电解质不一定都是共价化合物 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度就相同 |
12.下列指定试剂能检验对应一组物质的是( )
| 选项 | 试剂(必要时可加热 | 物质 |
| A | 硝酸银溶液 | 氯化钠溶液和碳酸钠溶液 |
| B | 氯气 | 硫酸亚铁溶液和FeCl2溶液 |
| C | MnO2 | 浓盐酸和稀硫酸 |
| D | 紫色石蕊试剂 | 次氯酸钙和次氯酸钠 |
| A. | A | B. | B | C. | C | D. | D |
19.设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
9.下列图示正确的是( )
| A. | 水合氢离子: | B. | 氢氧根: | C. | 水合钠离子: | D. | 水合氯离子: |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20gD2O含有的质子数为10NA | |
| B. | 1molNa2O2与足量水反应转移的电子数为NA,生成的气体的标况下的体积为22.4L | |
| C. | 1L0.1mol/LHF溶液中含有共价键数目为0.1NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
13. 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:
第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
①下列能判断该反应达到平衡的是C
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
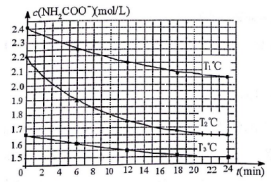
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
14.对于强碱性条件的甲醇燃料电池,下列说法正确的是( )
| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |