题目内容
13.常温下,对于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,④0.1mol•L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是( )
| A. | 水电离出的c(OH-):①>②>④>③ | |
| B. | ①和③混合后溶液呈中性:c(Na+)+c(H+)>c(CH3COO-)+c(Cl-) | |
| C. | ①和④混合后溶液呈酸性:$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$=1 | |
| D. | ③和④分别稀释100倍后的pH④<③ |
分析 A、对于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,④0.1mol•L-1CH3COOH溶液,只有醋酸钠会促进水的电离,其余都会抑制水的电离;
B、0.1mol•L-1CH3COONa溶液和pH=1的HC1溶液混合,得到的溶液遵循电荷守恒,据此回答;
C、0.1mol•L-1CH3COONa溶液和0.1mol•L-1CH3COOH溶液中存在2c(Na+)=c(CH3COO-)+c(CH3COOH),但是c(CH3COO-)≠c(CH3COOH);
D、pH=1的HC1的氢离子浓度大于0.1mol/L醋酸的浓度.
解答 解:A、对于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,④0.1mol•L-1CH3COOH溶液,只有醋酸钠会促进水的电离,其余都会抑制水的电离,水电离出的c(OH-):①>④>②=③,故A错误;
B、0.1mol•L-1CH3COONa溶液和pH=1的HC1溶液混合,得到的溶液遵循电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),所以c(Na+)=c(CH3COO-)+c(Cl-),c(Na+)+c(H+)>c(CH3COO-)+c(Cl-),故B正确;
C、0.1mol•L-1CH3COONa溶液和0.1mol•L-1CH3COOH溶液中存在2c(Na+)=c(CH3COO-)+c(CH3COOH),但是c(CH3COO-)≠c(CH3COOH),所以钠离子和醋酸根离子浓度不相等,故C错误;
D、pH=1的HC1的氢离子浓度大于0.1mol/L醋酸的浓度,分别稀释100倍后,pH:④>③,故D错误.
故选B.
点评 本题考查学生溶液中离子浓度之间的守恒关系、水的电离以及算的稀释等方面的知识,属于综合知识的考查,难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | Na2SO4、BaCl2、NaNO3、NaCl | B. | AgNO3、CaCl2、KNO3、MgCl2 | ||
| C. | Na2SO4、Na2CO3、BaCl2、HCl | D. | NaOH、BaCl2、KNO3、Na2CO3 |
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O | |
| B. | 向饱和Na2CO3溶液中通入过量的CO2:CO32-+CO2+H2O=2HCO3- | |
| C. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-=CuS↓+H2S↑ | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
| A. | 0.2 mol/L | B. | 0.3mol/L | C. | 0.4 mol/L | D. | 0.5 mol/L |
| A. | C4H10和C20H42 | B. | 一溴乙烷和1,2-二溴乙烷 | ||
| C. | 邻二甲苯和对二甲苯 | D. | C4H8和C3H6 |
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
| B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
| A. | A | B. | B | C. | C | D. | D |
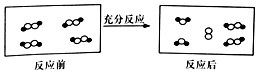 一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )| A. | 属于化合反应 | B. | 属于置换反应 | ||
| C. | 属于氧化还原反应 | D. | 属于复分解反应 |