题目内容
8.下列离子方程式正确的是( )| A. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量的金属铜加入到FeCl3溶液中:Fe3++Cu═Fe2++Cu2+ | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 将少量NaOH溶液与足量Ba(HCO3)2溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+2H2O+CO32- |
分析 A.二者反应生成氯化钙和水、二氧化碳;
B.电荷不守恒;
C.原子个数不守恒;
D.氢氧化钠少量,反应生成碳酸钡、碳酸氢钠和水.
解答 解:A.碳酸钙溶于稀盐酸中,离子方程式:CaCO3+2H+═Ca2++H2O+CO2↑,故A正确;
B.少量的金属铜加入到FeCl3溶液中,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.铝粉投入到NaOH溶液中,离子方程式:2H2O+2Al+2OH-═2AlO2-+3H2↑,故C错误;
D.将少量NaOH溶液与足量Ba(HCO3)2溶液混合,离子方程式:Ba2++HCO3-+OH-═BaCO3↓+H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式的书写,题目难度不大,注意反应物用量对反应的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列各组物质中,相互间一定互为同系物的是( )
| A. | C4H10和C20H42 | B. | 一溴乙烷和1,2-二溴乙烷 | ||
| C. | 邻二甲苯和对二甲苯 | D. | C4H8和C3H6 |
19.质量相同的下列物质,含分子数最少的是( )
| A. | 氢气 | B. | 氧气 | C. | 氮气 | D. | 二氧化碳 |
16.向20mL 2mol/L AlCl3溶液中加入30mL NaOH溶液,充分反应后得到0.78g沉淀,由此可知NaOH溶液的物质的量浓度应该是( )
①1mol/L ②2mol/L ③5mol/L ④8mol/L.
①1mol/L ②2mol/L ③5mol/L ④8mol/L.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
3.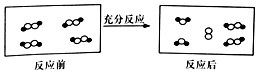 一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
 一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )| A. | 属于化合反应 | B. | 属于置换反应 | ||
| C. | 属于氧化还原反应 | D. | 属于复分解反应 |
13.在120℃的条件下,将体积比为1:1总质量为7.2g的CO与H2的混合气体在足量的O2中充分燃烧,然后将产生的气体通过足量的Na2O2固体中充分反应,反应后固体增加的质量为( )
| A. | 4.5 g | B. | 7.2 g | C. | 9.3 g | D. | 无法计算 |
20.下列说法正确的是( )
| A. | 铅蓄电池在放电过程中,负极质量增加,正极质量也增加 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,2.24 L CCl4含有0.1 NA个CCl4分子 | |
| B. | 18gD2O含有的质子数为10NA | |
| C. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 1.5molCu和足量稀硝酸反应产生NA个NO分子 |
5.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).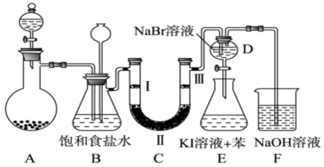
(1)固体二氧化锰和浓盐酸制备氯气的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填序号)
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2氧化性>Br2(填>、<或=).打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2.

(1)固体二氧化锰和浓盐酸制备氯气的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填序号)
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2.