题目内容
10.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)
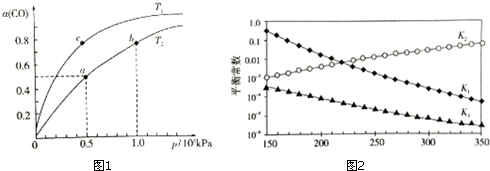
△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图1中a点的平衡常数KP=1.6×10-7(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$ CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示.则△H1>△H3(填“>”、“<”、“=”),理由是曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
分析 (1)依据化学反应焓变=反应物键能总和-生成物键能总和计算;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
②压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③达到化学平衡状态的是各物质的浓度不变,正逆反应速率相等;
④结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
(3)反应1、2、3其对应的平衡常数分别为K1、K2、K3,根据图1它们随温度变化的曲线结合盖斯定律进行分析解答.
解答 解:(1)反应焓变=反应物键能总和-生成物键能总和,即CO(g)+2H2(g)?CH3OH(g),x+2×436-413×3-343-465=-99,解之得x=1076,故答案为:1076;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b),故答案为:<;
②压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2,故答案为:<;
而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③a.只要反应发生就有H2的消耗速率是CH3OH生成速率的2倍,故错误;
b.CH3OH的体积分数不再改变,说明各物质的量不变,反应达平衡状态,故正确;
c.混合气体的密度不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
d.CO和CH3OH的物质的量之和保持不变,可能平衡也可能未平衡,故错误;
故选bc;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,Kp═$\frac{\frac{0.5}{2}×0.5}{\frac{0.5}{2}×0.5×(\frac{1}{2}×0.5)^{2}}$=1.6×10-7 (kPa)-2,故答案为:1.6×10-7 (kPa)-2;
(3)由图l可知,随着温度升高,K1减小,则反应1:CO2(g)+H2(g)?CO(g)+H2O(g)△H1<0,反应3由反应1+2所得,根据盖斯定律:△H3=△H1+△H2,所以△H2>△H3,
故答案为:>;曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,注意利用“定一议二”原则分析和化学平衡常数的计算.

 应用题作业本系列答案
应用题作业本系列答案| A. | 过量的SO2 通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| C. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
| A. | CO2 | B. | C2H2 | C. | H2O2 | D. | COCl2 |
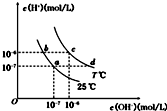
| A. | a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:ClO-、Ba2+、OH-、I- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl- HCO3- | |
| D. | d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |
| A | B | C |
| D | E | F |
(2)AC2的电子式为
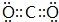 .
.(3)在一定条件下,由B单质与H2反应生成1molG时,放出的热量为46.2kJ,写出该反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式8NH3+3Cl2═6NH4Cl+N2.该反应中被氧化的G与参与反应的G的质量之比1:4.
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:2H2S+SO2=3S↓+2H2O.
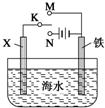 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.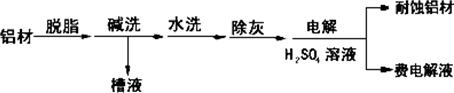
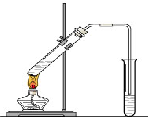 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O
CH3COOC2H5+H2O