题目内容
15. 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.(1)以下为铝材表面处理的一种方法:
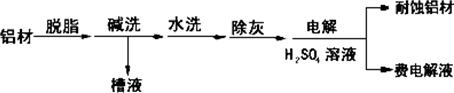
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,用离子方程式表示其原因2Al+2OH-+2H2O═2AlO+3H2↑.为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b(填字母序号). a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为2Al+3H2O-6e-═Al2O3+6H+
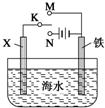
(2)利用图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处.
若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极保护法(或牺牲阳极的阴极保护法).
分析 (1)①有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法).
解答 解:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.3HCO3-+Al3+=3CO2↑+Al(OH)3↓;或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;
(2)金属的防护有牺牲阳极保法和外加电源阴极保护法,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法). 故答案为:N;牺牲阳极保护法(或牺牲阳极的阴极保护法).
点评 本题考查混合物分离提纯,为山东高考题,侧重于学生的分析与实验能力的考查,把握流程中的反应及混合物分离方法为解答该类题目的关键,注意水解原理、电化学反应原理的应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 原子序数:Z>X>W | |
| B. | 单质的沸点:Z>X | |
| C. | 原子的最外层电子数:Y>W>Z | |
| D. | 标准状况下,5.6LW的单质中含有0.5mol原子 |
| A. | 次氯酸钙有强氧化性,用于饮用水消毒 | |
| B. | 木炭具有还原性,用于制冰箱除味剂 | |
| C. | 氧化铝具有两性,用于工业冶炼铝单质 | |
| D. | 氯化铁溶液呈酸性,用于蚀刻铜电路板 |
| A. | 乙二醇 丙三醇 | B. | C6H5-OH C6H5CH2-OH | ||
| C. | C3H6 和C4H8 | D. | C2H6和C10H22 |
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)
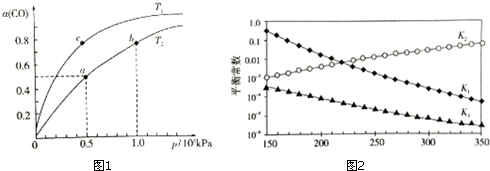
△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图1中a点的平衡常数KP=1.6×10-7(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$ CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示.则△H1>△H3(填“>”、“<”、“=”),理由是曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
| A. | 用盐酸除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| B. | 将Na放入水中 2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 氢氧化铝溶于盐酸 OH-+H+=H2O | |
| D. | 小苏打与氢氧化钠反应 HCO3-+H+=CO2↑+H2O |
| A. | CaO2的水解产物是Ca(OH)2和H2O2 | B. | NaClO的水解产物之一是HClO | ||
| C. | PCl3的水解产物是PH3和HClO | D. | Mg3N2水解生成NH3和Mg(OH)2 |
(1)液氨汽化(2)将胆矾加热变为白色粉末(3)浓硫酸稀释
(4)水的液化(5)酸碱中和生成水(6)氯化铵与氢氧化钡的反应.
| A. | (2)(6) | B. | (1)(2)(3)(6) | C. | (3) | D. | (2)(4)(6) |