题目内容
19.高温高压下,1L密闭容器中,发生如下反应:2H2+CO?CH3OH.反应开始时H2的物质的量为5mol,5min时变为0.5mol,则5min内该反应的平均反应速率v(H2) (单位:mol.L-1.min-1)为( )| A. | 9.0 | B. | 0.9 | C. | 0.45 | D. | 4.5 |
分析 反应速率表示单位时间内浓度的变化量,即反应速率v=$\frac{△C}{△t}$=$\frac{\frac{△n}{V}}{△t}$,据此计算.
解答 解:反应速率表示单位时间内浓度的变化量,反应开始时H2的物质的量为5mol,5min时变为0.5mol,则5min内H2的化学反应速率v(H2)=$\frac{\frac{5mol-0.5mol}{1L}}{5min}$=0.9mol•L-1•min-1,故选B.
点评 本题考查化学反应速率的计算,题目难度中等,注意反应速率的计算应用.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
10.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
则x=1076.
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)
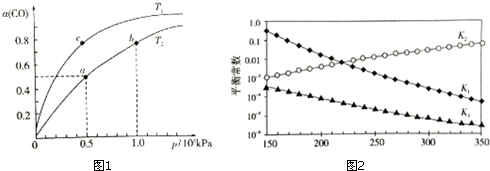
△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图1中a点的平衡常数KP=1.6×10-7(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$ CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示.则△H1>△H3(填“>”、“<”、“=”),理由是曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)
△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图1中a点的平衡常数KP=1.6×10-7(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).

(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$ CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示.则△H1>△H3(填“>”、“<”、“=”),理由是曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
7.下列离子方程式书写不正确的是( )
| A. | 用盐酸除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| B. | 将Na放入水中 2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 氢氧化铝溶于盐酸 OH-+H+=H2O | |
| D. | 小苏打与氢氧化钠反应 HCO3-+H+=CO2↑+H2O |
4.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述观点,下列说法正确的是( )
| A. | CaO2的水解产物是Ca(OH)2和H2O2 | B. | NaClO的水解产物之一是HClO | ||
| C. | PCl3的水解产物是PH3和HClO | D. | Mg3N2水解生成NH3和Mg(OH)2 |
11.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | HCl的电子式为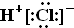 | B. | Cl-的结构示意图 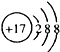 | ||
| C. | CO2的电子式 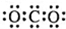 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
9.下列过程一定释放能量的是( )
| A. | 化合反应 | B. | 分解反应 | ||
| C. | 反应物分子中化学键断裂 | D. | 原子组合成分子 |
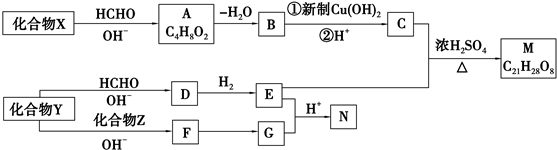
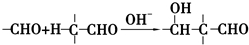
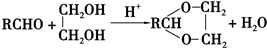
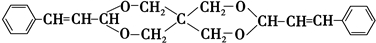
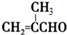 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$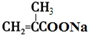 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.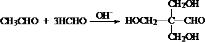 .
.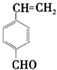 和
和 .
.