题目内容
A为两种固体的混合物,G和I为溶液D的组成成分,E为红褐色沉淀,J为淡黄色固体.反应所加的试剂均足量.
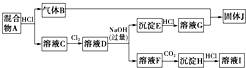
(1)混合物A一定含有的元素为(写元素符号) ;
(2)溶液F一定含有的阴离子为(写离子符号) ;
(3)写出B+G→J的化学方程式: ,写出溶液C→溶液D的离子方程式: ;
(4)溶液I中溶质的阳离子常作净水剂,其作用原理是(用离子方程式表示): .

(1)混合物A一定含有的元素为(写元素符号)
(2)溶液F一定含有的阴离子为(写离子符号)
(3)写出B+G→J的化学方程式:
(4)溶液I中溶质的阳离子常作净水剂,其作用原理是(用离子方程式表示):
考点:无机物的推断
专题:推断题
分析:E为红褐色沉淀,应为Fe(OH)3,与盐酸反应生成G为FeCl3,J为淡黄色固体,且在溶液中生成,应为S,则气体B应为H2S,由题目(4)溶液I中溶质的阳离子常作净水剂,可知I中含有Al3+,则沉淀H为Al(OH)3,溶液F中含有AlO2-,则D中含有Fe3+、Al3+等离子,C中含有Fe2+、Al3+,可知A应含有Fe、Al、S等元素,以此解答该题.
解答:
解:E为红褐色沉淀,应为Fe(OH)3,与盐酸反应生成G为FeCl3,J为淡黄色固体,且在溶液中生成,应为S,则气体B应为H2S,由题目(4)溶液I中溶质的阳离子常作净水剂,可知I中含有Al3+,则沉淀H为Al(OH)3,溶液F中含有AlO2-,则D中含有Fe3+、Al3+等离子,C中含有Fe2+、Al3+,可知A应含有Fe、Al、S等元素,
(1)由以上分析可知混合物A一定含有的元素为Fe、Al、S,故答案为:Fe、Al、S;
(2)由以上分析可知沉淀H为Al(OH)3,溶液F中含有AlO2-,由于A中加入盐酸,则F中含有Cl-,且D与过量的NaOH反应,则F中应含有OH-,
故答案为:Cl-、OH-、AlO2-;
(3)H2S具有还原性,可与FeCl3发生氧化还原反应,反应的方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl,C中含有Fe2+,具有还原性,通入氯气,被氧化生成Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:H2S+2FeCl3=2FeCl2+S↓+2HCl;2Fe2++Cl2=2Fe3++2Cl-;
(4)I中含有Al3+,可水解生成具有吸附性的Al(OH)3胶体,可用于净水,离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+.
(1)由以上分析可知混合物A一定含有的元素为Fe、Al、S,故答案为:Fe、Al、S;
(2)由以上分析可知沉淀H为Al(OH)3,溶液F中含有AlO2-,由于A中加入盐酸,则F中含有Cl-,且D与过量的NaOH反应,则F中应含有OH-,
故答案为:Cl-、OH-、AlO2-;
(3)H2S具有还原性,可与FeCl3发生氧化还原反应,反应的方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl,C中含有Fe2+,具有还原性,通入氯气,被氧化生成Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:H2S+2FeCl3=2FeCl2+S↓+2HCl;2Fe2++Cl2=2Fe3++2Cl-;
(4)I中含有Al3+,可水解生成具有吸附性的Al(OH)3胶体,可用于净水,离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+.
点评:本题考查元素化合物知识,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,多角度考查学生的元素化合物知识,本题注意以E、J的颜色为解答该题的突破口,难度中等.

练习册系列答案
相关题目
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-═ZnO+H2O Ag2O+H2O+2e-═2Ag+2OH-总反应为Ag2O+Zn═2Ag+ZnO.根据上述反应式,判断下列叙述中,正确的是( )
| A、在使用过程中,电池负极区溶液pH增大 |
| B、在使用过程中,电流由Ag2O极经外电路流向Zn极 |
| C、在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| D、外电路中每通过0.2mol电子,正极的质量理论上减小33.2g |

 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出).

