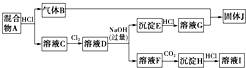
题目内容
有A、B、C、D、E、F、G七种物质,它们的每个分子中均含有18个电子,请根据要求回答问题:
(1)A物质的分子是含极性键的双原子分子.则A物质的电子式为 .B物质只由两种元素组成,常温下为一种气态有机物,其化学式为 .C物质是一种正在开发运用为汽车燃料的液态有机物,其结构简式为 .
(2)D、E之间可以发生氧化还原反应,放出大量的热,且无任何污染.已知D由两种非金属元素组成,常用作火箭燃料,且分子中原子个数比为1:2,E也由两种非金属元素组成,是一种“绿色”氧化剂.0.4mol液态D和足量液态E反应,生成两种气态产物,放出258.4kJ的热量.请写出该反应的热化学方程式 .
(3)F物质由3种元素组成,将气体F在氧气中充分燃烧后,得到由三种气体组成的混合气(在1atm,120℃下),其中两种是氢化物(分子中均含10个电子).该燃烧反应的化学方程式为 .
(4)G分子中含三个相同的极性键,与A发生化合反应生成一种离子化合物.请结合已学知识类比判断,写出G与A发生反应的化学方程式 .
(1)A物质的分子是含极性键的双原子分子.则A物质的电子式为
(2)D、E之间可以发生氧化还原反应,放出大量的热,且无任何污染.已知D由两种非金属元素组成,常用作火箭燃料,且分子中原子个数比为1:2,E也由两种非金属元素组成,是一种“绿色”氧化剂.0.4mol液态D和足量液态E反应,生成两种气态产物,放出258.4kJ的热量.请写出该反应的热化学方程式
(3)F物质由3种元素组成,将气体F在氧气中充分燃烧后,得到由三种气体组成的混合气(在1atm,120℃下),其中两种是氢化物(分子中均含10个电子).该燃烧反应的化学方程式为
(4)G分子中含三个相同的极性键,与A发生化合反应生成一种离子化合物.请结合已学知识类比判断,写出G与A发生反应的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F、G每个分子中均含有18个电子,
(1)A物质的分子是含极性键的双原子分子,则A物质为氯化氢,B物质只由两种元素组成,常温下为一种气态有机物,则B为乙烷,C物质是一种正在开发运用为汽车燃料的液态有机物,则C为甲醇,据此答题;
(2)D、E之间可以发生氧化还原反应,放出大量的热,且无任何污染.已知D由两种非金属元素组成,常用作火箭燃料,且分子中原子个数比为1:2,则D为N2H4,E也由两种非金属元素组成,是一种“绿色”氧化剂,则E为双氧水,据此答题;
(3)F物质由3种元素组成,将气体F在氧气中充分燃烧后,得到由三种气体组成的混合气(在1atm,120℃下),其中两种是氢化物(分子中均含10个电子),则F为CH3F,据此答题;
(4)G分子中含三个相同的极性键,与A发生化合反应生成一种离子化合物,则G为PH3,据此答题;
(1)A物质的分子是含极性键的双原子分子,则A物质为氯化氢,B物质只由两种元素组成,常温下为一种气态有机物,则B为乙烷,C物质是一种正在开发运用为汽车燃料的液态有机物,则C为甲醇,据此答题;
(2)D、E之间可以发生氧化还原反应,放出大量的热,且无任何污染.已知D由两种非金属元素组成,常用作火箭燃料,且分子中原子个数比为1:2,则D为N2H4,E也由两种非金属元素组成,是一种“绿色”氧化剂,则E为双氧水,据此答题;
(3)F物质由3种元素组成,将气体F在氧气中充分燃烧后,得到由三种气体组成的混合气(在1atm,120℃下),其中两种是氢化物(分子中均含10个电子),则F为CH3F,据此答题;
(4)G分子中含三个相同的极性键,与A发生化合反应生成一种离子化合物,则G为PH3,据此答题;
解答:
解:A、B、C、D、E、F、G每个分子中均含有18个电子,
(1)A物质的分子是含极性键的双原子分子,则A物质为氯化氢,它的电子式为 ,B物质只由两种元素组成,常温下为一种气态有机物,则B为乙烷,它的化学式为C2H6,C物质是一种正在开发运用为汽车燃料的液态有机物,则C为甲醇,它的结构简式为CH3OH,
,B物质只由两种元素组成,常温下为一种气态有机物,则B为乙烷,它的化学式为C2H6,C物质是一种正在开发运用为汽车燃料的液态有机物,则C为甲醇,它的结构简式为CH3OH,
故答案为: ;C2H6;CH3OH;
;C2H6;CH3OH;
(2)D、E之间可以发生氧化还原反应,放出大量的热,且无任何污染.已知D由两种非金属元素组成,常用作火箭燃料,且分子中原子个数比为1:2,则D为N2H4,E也由两种非金属元素组成,是一种“绿色”氧化剂,则E为双氧水,0.4mol液态D和足量液态E反应,生成两种气态产物,放出258.4kJ的热量,则1mol液态肼和足量液态双氧水反应放出646KJ的热,所以该反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-646KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-646KJ/mol;
(3)F物质由3种元素组成,将气体F在氧气中充分燃烧后,得到由三种气体组成的混合气(在1atm,120℃下),其中两种是氢化物(分子中均含10个电子),则F为CH3F,该燃烧反应的化学方程式为2CH3F+3O2
2HF+2H2O+2CO2,
故答案为:2CH3F+3O2
2HF+2H2O+2CO2;
(4)G分子中含三个相同的极性键,与A发生化合反应生成一种离子化合物,则G为PH3,它与HCl反应的化学方程式为PH3+HCl=PH4Cl,
故答案为:PH3+HCl=PH4Cl;
(1)A物质的分子是含极性键的双原子分子,则A物质为氯化氢,它的电子式为
 ,B物质只由两种元素组成,常温下为一种气态有机物,则B为乙烷,它的化学式为C2H6,C物质是一种正在开发运用为汽车燃料的液态有机物,则C为甲醇,它的结构简式为CH3OH,
,B物质只由两种元素组成,常温下为一种气态有机物,则B为乙烷,它的化学式为C2H6,C物质是一种正在开发运用为汽车燃料的液态有机物,则C为甲醇,它的结构简式为CH3OH,故答案为:
 ;C2H6;CH3OH;
;C2H6;CH3OH;(2)D、E之间可以发生氧化还原反应,放出大量的热,且无任何污染.已知D由两种非金属元素组成,常用作火箭燃料,且分子中原子个数比为1:2,则D为N2H4,E也由两种非金属元素组成,是一种“绿色”氧化剂,则E为双氧水,0.4mol液态D和足量液态E反应,生成两种气态产物,放出258.4kJ的热量,则1mol液态肼和足量液态双氧水反应放出646KJ的热,所以该反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-646KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-646KJ/mol;
(3)F物质由3种元素组成,将气体F在氧气中充分燃烧后,得到由三种气体组成的混合气(在1atm,120℃下),其中两种是氢化物(分子中均含10个电子),则F为CH3F,该燃烧反应的化学方程式为2CH3F+3O2
| ||
故答案为:2CH3F+3O2
| ||
(4)G分子中含三个相同的极性键,与A发生化合反应生成一种离子化合物,则G为PH3,它与HCl反应的化学方程式为PH3+HCl=PH4Cl,
故答案为:PH3+HCl=PH4Cl;
点评:本题主要考查了18电子分子,难度不大,答题时注意运用拆分的思想,将18电子分成1+17或2+16或9+9等,将相应的基团进行组合可以得到相关物质.

练习册系列答案
相关题目
圆明园12生肖铜首在1860年被侵略中国的英法联军掠夺后,至今只有牛首、猴首、虎首、猪首和马首回归中国普通铜器时间稍久就会出现铜绿,但这几件1760年铜铸的国宝在200多年后看上去仍然熠熠生辉.下列对其原因的分析最可能正确的是( )
| A、它们的表面都镀上了一层耐腐蚀的黄金 |
| B、环境污染特别严重,它们表面的铜绿被酸雨溶解洗去 |
| C、铜不易被氧化 |
| D、它们是含一定比例金、银、锡、锌的铜合金 |
 25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )
25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )| A、在A点c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在B点c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、在C点c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D、在C点c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
某学生将溴乙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果未见到预期的现象,其主要原因是( )
| A、加热时间太短 |
| B、加AgNO3溶液前未用稀HNO3酸化 |
| C、应该和NaOH的乙醇溶液共热 |
| D、不应该冷却后再滴入AgNO3溶液 |
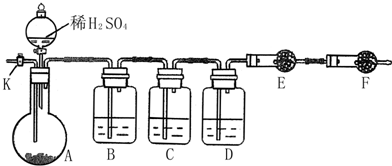 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)