题目内容
20.N2+3H2$?_{高温高压}^{催化剂}$2NH3制造氮肥的重要反应.下列关于该反应的说法正确的是( )| A. | 增加N2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | N2足量时,H2能100%转化为NH3 |
分析 该反应为可逆反应,反应物的转化率不可能达到100%,结合浓度、温度、催化剂对反应速率的影响解答该题.
解答 解:A.反应物的浓度增大,反应速率增大,故A正确;
B.升高温度能增大反应速率,则降低温度减小反应速率,故B错误;
C.加入催化剂能增大反应速率,故C错误;
D.该反应为可逆反应,反应物的转化率不可能达到100%,故D错误.
故选A.
点评 本题考查化学反应速率的影响,为高频考点,题目较为基础,注意可逆反应的特点,可逆反应正逆反应同时进行,反应物不可能完全转化.

练习册系列答案
相关题目
8.下列有关环境污染的说法正确的是( )
| A. | 烧煤时加入适量石灰石,可减少废气中SO2的量 | |
| B. | 二氧化碳是“城市空气质量日报”报道内容之一 | |
| C. | pH在 5.6~7之间的降水通常称为酸雨 | |
| D. | 某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 |
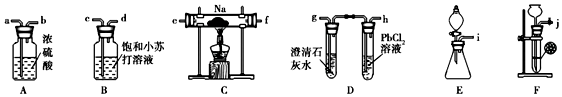
15.从海带中提取碘,可经过一下实验不走完成.
海带$\stackrel{灼烧}{→}$海带灰$→_{溶解}^{30mL蒸馏水}$ $\stackrel{蒸沸}{→}$$\stackrel{过滤}{→}$ 滤液$→_{氧化}^{2mL稀H_{2}SO_{4},5mLH_{2}O_{3}}$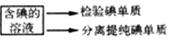
( )
海带$\stackrel{灼烧}{→}$海带灰$→_{溶解}^{30mL蒸馏水}$ $\stackrel{蒸沸}{→}$$\stackrel{过滤}{→}$ 滤液$→_{氧化}^{2mL稀H_{2}SO_{4},5mLH_{2}O_{3}}$
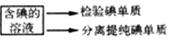
( )
| A. | 在灼烧过程中使用的玻璃仪器有酒精灯、玻璃棒、坩埚 | |
| B. | 在上述氧化过程中发生反应的离子方程式为2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 |
5.铝的熔沸点比镁高的原因是( )
| A. | 镁比铝活泼 | B. | 铝的化合价比镁高 | ||
| C. | 铝能与酸碱反应 | D. | 铝比镁的价电子多,半径比镁小 |
12.某烃分子中含有一个双键和一个叁键,则它的分子式可能是( )
| A. | C4H6 | B. | C5H6 | C. | C7H8 | D. | C10H8 |
9.苯甲酸乙酯可用作食用香料.某小组用如下装置制备苯甲酸乙酯反应原理:
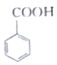 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$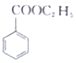 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如表:
实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品.
回答下列问题:
(1)仪器C的名称蒸馏烧瓶.
(2)步骤①若加热后才发现未加沸石,应采取的措施是停止加热,待反应液冷却后,再补加沸石;步骤②采取水浴加热的优点是便于控制温度且受热均匀.
(3)步骤③为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是将B中液体沿器壁缓慢加入水中并不断搅拌.
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有分液漏斗,使用该仪器之前需要进行的操作是检漏;无水MgSO4的作用是作干燥剂.
(5)步骤⑤收集馏分应控制的最佳温度为213℃.
(6)为了提高苯甲酸乙酯的产率,可以采取的措施增大乙醇的用量、对③中水层进行再萃取或适当增加浓H2SO4用量(任填一种).

 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$ (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O产物和部分反应物相关数据如表:
| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品.
回答下列问题:
(1)仪器C的名称蒸馏烧瓶.
(2)步骤①若加热后才发现未加沸石,应采取的措施是停止加热,待反应液冷却后,再补加沸石;步骤②采取水浴加热的优点是便于控制温度且受热均匀.
(3)步骤③为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是将B中液体沿器壁缓慢加入水中并不断搅拌.
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有分液漏斗,使用该仪器之前需要进行的操作是检漏;无水MgSO4的作用是作干燥剂.
(5)步骤⑤收集馏分应控制的最佳温度为213℃.
(6)为了提高苯甲酸乙酯的产率,可以采取的措施增大乙醇的用量、对③中水层进行再萃取或适当增加浓H2SO4用量(任填一种).