题目内容
11.某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳、也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.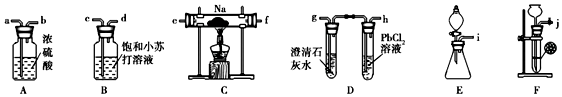
(1)他们欲用上述仪器组装一套装置:用石灰石与盐酸反应制取CO2(能随意控制反应的进行)来证明钠能在CO2中燃烧并检验气态还原产物,所用仪器接口连接顺序为jcdabefg(e与f可颠倒),制取CO2反应的离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑.
(2)装置连接好后,首先要进行的实验操作是检查装置的气密性,点燃酒精灯前,应进行的操作是打开F中导管上的止水夹,等装置D中澄清石灰水变浑浊(填写装置字母代号及现象)时,再点燃酒精灯,这步操作的目的是排尽装置内的空气.
(3)若装置D的PdCl2溶液中有黑色沉淀,C中有残留固体(只有一种物质),则C中反应的化学方程式为2Na+2CO2═Na2CO3+CO;若装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),则C中反应的化学方程式为4Na+3CO2═2Na2CO3+C.
(4)后来有一位同学提出,钠的氧化产物也可能是Na2O,因此要最终确定钠的氧化产物是何种物质,还需要检验C中残留的固体是否含有Na2O,为此,他认为应较长时间通入CO2以确保钠反应完,然后按照如下方案进行实验,可确定残留固体中是否含有Na2O,他的实验方案是将残留固体溶于水,在所得水溶液中加入过量BaCl2溶液,再向溶液中滴加2滴酚酞试液,若溶液变红色,则残留固体中含有Na2O,否则不含Na2O..
分析 (1)先选择二氧化碳发生装置,然后对制取的二氧化碳进行进行除杂、干燥,再通入大试管让钠与二氧化碳反应,最后检验反应产物,按照此顺序进行连接装置;写出碳酸钙与稀盐酸的离子方程式;
(2)实验前必须检查装置的气密性;钠易与氧气反应,故点燃酒精灯前,应该用CO2将装置内空气排出,据此完成实验操作及实验现象;
(3)根据装置D的PdCl2溶液中是否有黑色沉淀及C中有残留固体种类判断金属钠与二氧化碳反应产物,根据反应产物写出反应的化学方程式;
(4)先加入过量氯化钡溶液除去碳酸根离子,然后根据溶液是否显示碱性判断残留固体中是否含有Na2O.
解答 解:(1)装置F可通过关闭或打开导管上的止水夹实现对制气反应的控制,所以制取装置选用F,制取的CO2中含有HCl、H2O(g),可分别用饱和NaHCO3溶液、浓硫酸除去,所用装置接口连接顺序为:jcdabefg(e与f可颠倒);制取二氧化碳的离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,
故答案为:jcdabefg(e与f可颠倒);CaCO3+2H+═Ca2++H2O+CO2↑;
(2)装置连接好后,首先需要检验装置的气密性;由于钠易与氧气反应,故点燃酒精灯前,先打开F中导管上的止水夹,用CO2将装置内空气排出,当D中澄清石灰水变浑浊时,表明装置中空气已排尽,
故答案为:检查装置的气密性;打开F中导管上的止水夹;D中澄清石灰水变浑浊;排尽装置内的空气;
(3)当C中残留固体只有一种而D中的PdCl2溶液中有黑色沉淀时,表明反应的产物是Na2CO3与CO,反应的化学方程式为:2Na+2CO2═Na2CO3+CO;当C中固体有两种而D中的PdCl2溶液中没有黑色固体出现时,表明生成物是Na2CO3与单质碳,反应的化学方程式为:4Na+3CO2═2Na2CO3+C,
故答案为:2Na+2CO2═Na2CO3+CO;4Na+3CO2═2Na2CO3+C;
(4)将C中残留固体溶于水,加过量钡盐除去CO32-,再检验溶液是否呈碱性,若呈碱性,则表明固体中有Na2O,否则不含Na2O,
故答案为:将残留固体溶于水,在所得水溶液中加入过量BaCl2溶液,再向溶液中滴加2滴酚酞试液,若溶液变红色,则残留固体中含有Na2O,否则不含Na2O.
点评 本题考查了碱金属及其化合物的性质,该题是高考中的常见题型,属于中等难度的试题.试题基础性强,在注重对学生基础知识训练和检验的同时,侧重对学生实验答题能力的培养和方法与技巧的指导和训练,有利于提高学生的实验设计能力和应试能力,提升学生的学科素养.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | 增加N2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | N2足量时,H2能100%转化为NH3 |
| A. | 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol•L-1•s-1 | |
| B. | c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间小于10 s | |
| C. | 升高温度正反应速率加快,逆反应速率减慢 | |
| D. | 减小反应体系的体积,化学反应速率加快 |
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 3:4 |
| A. | 硫酸钡 | B. | 石墨 | C. | 浓盐酸 | D. | HF |
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境无污染 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 往新制备的氯水中和SO2的水溶液中分别滴入石蕊试液时的现象不同 |
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | Ag(s)+$\frac{1}{2}$Cl2(g)═AgCl(s)△H=-127 kJ•mol-1 | |
| C. | HgO(s)═Hg(l)+$\frac{1}{2}$O2(g)△H=+91 kJ•mol-1 | |
| D. | H2O2(l)═$\frac{1}{2}$O2(g)+H2O(l)△H=-98 kJ•mol-1 |

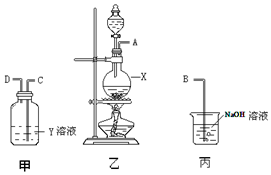 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用图所示的装置的组合进行实验.