题目内容
理论上不能用于设计成原电池的反应是( )
| A、2H2(g)+O2(g)═2H2O(l)△H<0 |
| B、HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0 |
| C、2Al(s)+3Cl2(g)═2AlCl3(s)△H<0 |
| D、Zn(s)+2HCl(aq)═ZnCl2+H2(g)△H<0 |
考点:设计原电池
专题:
分析:根据自发进行的放热的氧化还原反应能设计成原电池,分析解答.
解答:
解:A.2H2(g)+O2(g)═2H2O(l)是自发进行的、放热的氧化还原反应,能设计成燃料原电池,故A不选;
B.HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)是自发进行的放热的反应,但不是氧化还原反应,所以不能设计成原电池,故B选;
C.2Al(s)+3Cl2(g)═2AlCl3(s)是自发进行的、放热的氧化还原反应,能设计成原电池,故C不选;
D.Zn(s)+2HCl(aq)═ZnCl2+H2(g)是自发进行的、放热的氧化还原反应,能设计成原电池,故D不选;
故选B.
B.HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)是自发进行的放热的反应,但不是氧化还原反应,所以不能设计成原电池,故B选;
C.2Al(s)+3Cl2(g)═2AlCl3(s)是自发进行的、放热的氧化还原反应,能设计成原电池,故C不选;
D.Zn(s)+2HCl(aq)═ZnCl2+H2(g)是自发进行的、放热的氧化还原反应,能设计成原电池,故D不选;
故选B.
点评:本题考查了原电池原理,知道原电池反应特点是解本题关键,这几个条件必须同时具备才能设计成原电池,缺一不可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
| A、溶液中有晶体析出,Na+数目不变 |
| B、溶液中有气体逸出,Na+数目增加 |
| C、溶质的质量分数增大 |
| D、溶液中Na+数目减少,溶质质量分数未变 |
Al粉投入某无色澄清的溶液中产生H2,则下列离子组合正确的是( )
| A、H+、Ca2+、Na+、CO32- |
| B、Mg2+、Al3+、SO42-、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、K+、Na+、OH-、SO42- |
2012年我国载人飞船再次升空,显示出我国航天技术已进入世界一流.飞船应用了许多尖端的合成材料.据报道我国科学家近年来研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的.下列相关叙述不正确的是( )
| A、它耐高温抗氧化 |
| B、它比钢铁轻、硬,但质地较脆 |
| C、它没有固定熔点 |
| D、它是一种新型无机非金属材料 |



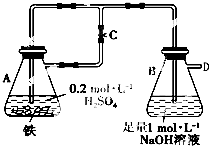 铁是人类应用较早,当前应用量最大的金属元素.
铁是人类应用较早,当前应用量最大的金属元素.