题目内容
某金属M的氢氧化物的水合晶体[M(OH)2?xH2O]与Na2CO3的混合物共36.800g,加入足量的水后,生成MCO3的白色沉淀,将沉淀滤出,洗净烘干,其质量为9.850g.
(1)将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体 mol.
(2)滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况),滤液中OH?的物质的量为 mol.
(3)M的相对原子质量为 ;试通过计算确定M(OH)2?xH2O中x的值: .
(1)将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体
(2)滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况),滤液中OH?的物质的量为
(3)M的相对原子质量为
考点:化学方程式的有关计算
专题:计算题
分析:(1)MCO3
MO+CO2↑来求解;
(2)根据方程式M(OH)2+Na2CO3=MCO3↓+2NaOH、NH4++OH-
NH3+H2O来计算;
(3)根据方程式MCO3
MO+CO2↑来计算;根据所求结果结合题意:金属M的氢氧化物的水合晶体M(OH)2?xH2O与Na2CO3的混合物共36.800g来计算.
| ||
(2)根据方程式M(OH)2+Na2CO3=MCO3↓+2NaOH、NH4++OH-
| ||
(3)根据方程式MCO3
| ||
解答:
解:(1)MCO3
MO+CO2↑,知n(CO2)=
=0.05,故答案为:0.05;
(2)设混合物含M(OH)2?xH2O的物质的量为amol,含Na2CO3b mol,滤液与酸作用不产生气体,所以滤液中不含CO32-,即Na2CO3完全反应.
M(OH)2+Na2CO3=MCO3↓+2NaOH
1 1 1
b b b
n(OH-)=2amol,根据NH4++OH-
NH3+H2O,则n(OH-)=n(NH3)=
=0.2 mol即2a=0.2mol,a=0.1mol,所以n(OH-)=0.2mol,
故答案为:0.2;
(3)设M的相对原子质量为m,
则:MCO3
MO+CO2↑
m+60 m+16
9.850 7.650
所以
=
,解得:m=137,
M是Ba,m(MCO3)=(137+60)×b=9.850,即b=0.05 mol,m(M(OH)2?xH2O)+m(Na2CO3)=36.800,
即(137+34+18x)×0.1+106×0.05=36.800,解得x=8,所以M氢氧化物的水合晶体的化学式为Ba(OH)2?8H2O,
故答案为:137;8.
| ||
| 9.850g -7.650g |
| 44g/mol |
(2)设混合物含M(OH)2?xH2O的物质的量为amol,含Na2CO3b mol,滤液与酸作用不产生气体,所以滤液中不含CO32-,即Na2CO3完全反应.
M(OH)2+Na2CO3=MCO3↓+2NaOH
1 1 1
b b b
n(OH-)=2amol,根据NH4++OH-
| ||
| 4.48L |
| 22.4L/mol |
故答案为:0.2;
(3)设M的相对原子质量为m,
则:MCO3
| ||
m+60 m+16
9.850 7.650
所以
| m+60 |
| 9.850 |
| m+16 |
| 7.650 |
M是Ba,m(MCO3)=(137+60)×b=9.850,即b=0.05 mol,m(M(OH)2?xH2O)+m(Na2CO3)=36.800,
即(137+34+18x)×0.1+106×0.05=36.800,解得x=8,所以M氢氧化物的水合晶体的化学式为Ba(OH)2?8H2O,
故答案为:137;8.
点评:本题考查学生根据化学方程式来确定物质以及量的多少的计算能力,注意平时知识的积累,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
下表中,所用仪器与实验目的不相符的是( )
| 选项 | 仪器 | 实验目的 |
| A | 分液漏斗 | 分离互不混溶的液体 |
| B | 普通漏斗 | 分离固体与液体 |
| C | 天平 | 称量一定质量的固体 |
| D | 烧杯 | 准确量取一定体积的液体 |
| A、A | B、B | C、C | D、D |
下列关于胶体的说法中正确的是( )
| A、胶体粒子直径小于1nm |
| B、胶体粒子不能通过半透膜 |
| C、胶体带电荷,在电场中会定向运动 |
| D、胶体不稳定,静置后容易产生沉淀 |
下列有关物质性质的叙述正确的是( )
| A、粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| B、SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |
| C、乙烯能使溴水、酸性高锰酸钾溶液褪色,说明乙烯具有漂白性 |
| D、铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,因为铁钉表面形成了一层致密稳定的氧化膜 |
同分异构现象是造成有机物种类繁多的重要原因之一.下列各组物质中互为同分异构体的是( )
| A、13C与14C |
| B、CH3CH2OH与CH3COOH |
| C、甲烷与丙烷 |
D、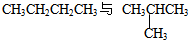 |
