题目内容
某同学称取9g淀粉溶于水,测定淀粉的水解百分率.其程序如下
(1)各步加入的试剂为:
A ,B ,C .
(2)加入A溶液而不加入B溶液是否可以 (填“可以”或“不可以”),其理由是
.
(3)若析出1.44g红色沉淀,淀粉的水解率是 .

(1)各步加入的试剂为:
A
(2)加入A溶液而不加入B溶液是否可以
.
(3)若析出1.44g红色沉淀,淀粉的水解率是
考点:蔗糖与淀粉的性质实验
专题:有机物的化学性质及推断
分析:淀粉在酸性条件下发生水解生成葡萄糖,葡萄糖含有醛基与新制的氢氧化铜发生氧化还原反应生成砖红色的沉淀,该反应须在碱性环境下进行,所以要想测定淀粉的水解百分率,程序为:在淀粉溶液中加入稀硫酸,淀粉在酸性条件下水解生成葡萄糖,然后加入Na0H溶液中和稀硫酸,使混合液呈碱性,加入新制氢氧化铜溶液,加热至沸腾生成红色沉淀,证明淀粉已水解,由水解后的溶液加碘水变蓝,则说明水解不完全;
依据写出淀粉水解的方程式,依据1mol-CHO~1molCu2O,根据生成的Cu2O质量求出水解的淀粉的质量,淀粉的水解率=
×100%.
依据写出淀粉水解的方程式,依据1mol-CHO~1molCu2O,根据生成的Cu2O质量求出水解的淀粉的质量,淀粉的水解率=
| 已水解的淀粉的质量 |
| 淀粉的总质量 |
解答:
解:(1)淀粉在稀硫酸作用下水解生成葡萄糖,然后加入Na0H溶液中和稀硫酸,使混合液呈碱性,加入新制氢氧化铜溶液,加热至沸腾生成红色沉淀,
所以加入的试剂:A为H2SO4,B为NaOH,C为新制的Cu(OH)2悬浊液,
故答案为:H2SO4;NaOH;新制的Cu(OH)2悬浊液;
(2)葡萄糖含有醛基与新制的氢氧化铜在碱性环境下进行发生氧化还原反应生成砖红色的沉淀,所以加入稀硫酸而不加入氢氧化钠,溶液呈酸性,反应不能进行,
故答案为:否;因为葡萄糖与新制的氢氧化铜在碱性环境下才能发生氧化反应;
(3)淀粉水解的方程式为:(C6H10O5)n(淀粉)+nH2O
nC6H12O6(葡萄糖),
一元醛与新制氢氧化铜反应的方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2
CH2OH(CHOH)4COOH+2H2O+Cu2O↓,
设水解的淀粉的质量为x则:
(C6H10O5)n~nC6H12O6~nCu2O
162n 144n
x 1.44 g
x=
=1.62 g,
淀粉的水解率=
×100%=
×100%=18%,
故答案为:18%.
所以加入的试剂:A为H2SO4,B为NaOH,C为新制的Cu(OH)2悬浊液,
故答案为:H2SO4;NaOH;新制的Cu(OH)2悬浊液;
(2)葡萄糖含有醛基与新制的氢氧化铜在碱性环境下进行发生氧化还原反应生成砖红色的沉淀,所以加入稀硫酸而不加入氢氧化钠,溶液呈酸性,反应不能进行,
故答案为:否;因为葡萄糖与新制的氢氧化铜在碱性环境下才能发生氧化反应;
(3)淀粉水解的方程式为:(C6H10O5)n(淀粉)+nH2O
| 催化剂 |
一元醛与新制氢氧化铜反应的方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2
| △ |
设水解的淀粉的质量为x则:
(C6H10O5)n~nC6H12O6~nCu2O
162n 144n
x 1.44 g
x=
| 162n×1.44g |
| 144n |
淀粉的水解率=
| 已水解的淀粉的质量 |
| 淀粉的总质量 |
| 1.62g |
| 9g |
故答案为:18%.
点评:本题考查了淀粉、葡萄糖的性质,题目难度不大,解题时注意淀粉水解的条件和醛与新制氢氧化铜反应的条件.

练习册系列答案
相关题目
下列四组溶液中,其中可用稀硫酸进行鉴别的一组是( )
| A、BaCl2、Ba(NO3)2、Na2CO3 |
| B、Na2CO3、BaCl2、NaCl |
| C、Ba(NO3)2、KCl、MgCl2 |
| D、Na2CO3、K2CO3、NaCl |
下列各组物质中,互为同分异构体的是( )
| A、O2和O3 | ||||
B、
| ||||
| C、CH4和CH3CH3 | ||||
D、 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
下列说法或表示方法正确的是( )
| A、反应物总能量低于生成物总能量时,该反应不能发生 |
| B、稀的强酸与稀的强碱反应放出的热量就是中和热 |
| C、由C(石墨)(s)→C(金刚石)(s);△H>0可行,石墨比金刚石稳定 |
| D、在101kPa,25℃时,2gH2完全燃烧生成液态水,放出285.8kJ的热量;氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(1);△H=-285.8kJ/mol |

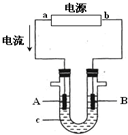 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下