题目内容
甲元素的原子序数是9,乙是元素周期表第三周期中金属性最强的元素,丙元素原子核外有三个电子层,最外层电子层上有6个电子,丁元素比丙多一个质子,由此推断:
(1)甲元素在周期表中位于第二周期的 族
(2)甲元素的气态氢化物的稳定性比HCl的 (填“强”或“弱”)
(3)乙元素单质在空气中燃烧,生成一种淡黄色的固体的名称是 ,指出它所含的化学键的类型 .
(4)乙元素原子半径比丙元素原子 (填大或小)
(5)丙元素最高价氧化物的水化物的分子式是 ,它的酸性比磷酸的 ( 填“强”或“弱”)
(1)甲元素在周期表中位于第二周期的
(2)甲元素的气态氢化物的稳定性比HCl的
(3)乙元素单质在空气中燃烧,生成一种淡黄色的固体的名称是
(4)乙元素原子半径比丙元素原子
(5)丙元素最高价氧化物的水化物的分子式是
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:甲元素的原子序数是9,则甲为F;乙是元素周期表第三周期中金属性最强的元素,则乙为Na;丙元素原子核外有三个电子层,最外层电子层上有6个电子,则丙为S,丁元素比丙多一个质子,则丁为Cl,
(1)主族元素族序数=最外层电子数;
(2)非金属性越强,氢化物越稳定;
(3)Na在空气中燃烧生成过氧化钠,过氧化钠属于离子化合物,过氧根离子中氧原子之间形成共价键;
(4)同周期随原子序数增大,原子半径减小;
(5)丙元素最高价氧化物的水化物为硫酸,非金属性越强,最高价含氧酸的酸性越强.
(1)主族元素族序数=最外层电子数;
(2)非金属性越强,氢化物越稳定;
(3)Na在空气中燃烧生成过氧化钠,过氧化钠属于离子化合物,过氧根离子中氧原子之间形成共价键;
(4)同周期随原子序数增大,原子半径减小;
(5)丙元素最高价氧化物的水化物为硫酸,非金属性越强,最高价含氧酸的酸性越强.
解答:
解:甲元素的原子序数是9,则甲为F;乙是元素周期表第三周期中金属性最强的元素,则乙为Na;丙元素原子核外有三个电子层,最外层电子层上有6个电子,则丙为S,丁元素比丙多一个质子,则丁为Cl,
(1)甲为F元素,原子最外层电子数为7,处于第二周期的ⅦA族,故答案为:ⅦA;
(2)非金属性F>Cl,非金属性越强,氢化物越稳定,故稳定性HF>HCl,故答案为:强;
(3)Na在空气中燃烧生成过氧化钠,过氧化钠属于离子化合物,过氧根离子中氧原子之间形成共价键,含有离子键、共价键,
故答案为:过氧化钠;离子键、共价键;
(4)Na、S同周期,随原子序数增大,原子半径减小,故原子半径Na>S,故答案为:大;
(5)丙元素最高价氧化物的水化物为H2SO4,非金属性S>P,故最高价含氧酸的酸性H2SO4>H3PO4,故答案为:H2SO4;强.
(1)甲为F元素,原子最外层电子数为7,处于第二周期的ⅦA族,故答案为:ⅦA;
(2)非金属性F>Cl,非金属性越强,氢化物越稳定,故稳定性HF>HCl,故答案为:强;
(3)Na在空气中燃烧生成过氧化钠,过氧化钠属于离子化合物,过氧根离子中氧原子之间形成共价键,含有离子键、共价键,
故答案为:过氧化钠;离子键、共价键;
(4)Na、S同周期,随原子序数增大,原子半径减小,故原子半径Na>S,故答案为:大;
(5)丙元素最高价氧化物的水化物为H2SO4,非金属性S>P,故最高价含氧酸的酸性H2SO4>H3PO4,故答案为:H2SO4;强.
点评:本题考查结构性质物质关系应用,为高频考点,侧重于学生的分析能力的考查,注意元素周期律的理解掌握,把握元素结构与元素周期表的关系,难度不大.

练习册系列答案
相关题目
下列说法或表示方法正确的是( )
| A、反应物总能量低于生成物总能量时,该反应不能发生 |
| B、稀的强酸与稀的强碱反应放出的热量就是中和热 |
| C、由C(石墨)(s)→C(金刚石)(s);△H>0可行,石墨比金刚石稳定 |
| D、在101kPa,25℃时,2gH2完全燃烧生成液态水,放出285.8kJ的热量;氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(1);△H=-285.8kJ/mol |
物质(括号内为杂质)的提纯方法错误的一组是( )
| A、碘化钾(碘):加热升华 |
| B、乙醇(水):加新制生石灰蒸馏 |
| C、二氧化碳(二氧化硫):通过氢氧化钠溶液 |
| D、乙酸乙酯(乙酸):加饱和碳酸钠溶液后分液 |
下列不属于自发进行的变化是( )
| A、红墨水加到清水使整杯水变红 |
| B、冰在室温下融化成水 |
| C、电解饱和食盐水 |
| D、铁器在潮湿的空气中生锈 |
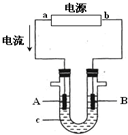 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下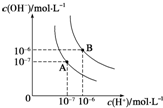 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=