题目内容
2.下列各组物质中,所含分子数一定相同的是( )| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
分析 各组物质中所含分子数一定相同,根据N=nNA可知两物质的物质的量相等,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算出各物质的物质的量,然后进行判断即可.
解答 解:A.1g氢气的物质的量为:$\frac{1g}{2g/mol}$=0.5mol,1g氧气的物质的量为:$\frac{1g}{32g/mol}$=$\frac{1}{32}$mol,二者物质的量不相等,则含有的分子数不相等,故A错误;
B.不是标准状况下,无法计算2.24L He的物质的量,故B错误;
C.150℃,1.01×105Pa时水为气态,二者体积相等,根据n=$\frac{V}{{V}_{m}}$可知二者物质的量相等,含有的分子数相等,故C正确;
D.28gCO的物质的量为:$\frac{28g}{28g/mol}$=1mol,6.02×1022个CO分子的物质的量为0.1mol,二者物质的量不同,含有的分子数不同,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确气体摩尔体积的使用条件为解答关键,注意掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12. 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g)?CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为20500kJ.
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如表所示:
①T1>T2(填“>”、“=”或“<”);T1℃时,该反应的平衡常数K=12.8.
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是大于0.8mol/L,小于1.4mol/L.
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
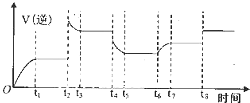
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,从t1到t8哪个时间段H2O(g)的平衡转化率最低t7-t8.
 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:方法①:C(s)+2H2O(g)?CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为20500kJ.
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是大于0.8mol/L,小于1.4mol/L.
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,从t1到t8哪个时间段H2O(g)的平衡转化率最低t7-t8.
7.对于反应中的能量变化,表述正确的是( )
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
14.某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.100mol•L-1稀盐酸和0.100mol•L-1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100g),研碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.100mol•L-1氢氧化钠溶液滴定,用去体积为V时达到终点
④加入25.00mL 0.100mol•L-1稀盐酸.
请回答下列问题
(1)测定过程的正确操作顺序为:①②④③或②①④③(填序号).
(2)测定过程中发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O.
(3)若某次实验需重复测定4次.实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为250mL,理由是4次需100 mL,因实验操作过程中需润洗滴定管、调液面、赶气泡等消耗HCl,故需用量要大于100 mL.
(4)某同学四次测定的V数据如表:
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数60.0%.
(5)下列实验操作会引起测量结果偏低的是①②④⑤.
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡.
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水.④滴定管用蒸馏水洗后,未用标准液洗. ⑤读取滴定管终点读数时,仰视刻度线.
①配制0.100mol•L-1稀盐酸和0.100mol•L-1氢氧化钠溶液,
②取一粒药片(药片质量相同,均为0.100g),研碎后加入20.0mL蒸馏水
③以酚酞为指示剂,用0.100mol•L-1氢氧化钠溶液滴定,用去体积为V时达到终点
④加入25.00mL 0.100mol•L-1稀盐酸.
请回答下列问题
(1)测定过程的正确操作顺序为:①②④③或②①④③(填序号).
(2)测定过程中发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O.
(3)若某次实验需重复测定4次.实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为250mL,理由是4次需100 mL,因实验操作过程中需润洗滴定管、调液面、赶气泡等消耗HCl,故需用量要大于100 mL.
(4)某同学四次测定的V数据如表:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
(5)下列实验操作会引起测量结果偏低的是①②④⑤.
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡.
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ③中和滴定时,锥形瓶内有少量蒸馏水.④滴定管用蒸馏水洗后,未用标准液洗. ⑤读取滴定管终点读数时,仰视刻度线.
11.(1)氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究.
氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g)?2NH3(g)△H=-92.4kJ/mol

计算断裂1mol N≡N键需要能量946kJ,氮气分子中化学键比氧气分子中的化学键强(填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:
N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.分析两种固氮反应的平衡常数,下列结论正确的是BC.
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:2NO2?N2O4.每隔一定时间就对该容器内的物质进行分析,得到如表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.0025mol/(L•s).
②上述反应达到平衡后四氧化二氮的体积分数为25%,
③达到平衡后,恒温下如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,此时有关反应的V(正)、V(逆)速率的说法正确的是BC
A.都增大 B.都减小 C.V(正)<V(逆)
氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g)?2NH3(g)△H=-92.4kJ/mol

计算断裂1mol N≡N键需要能量946kJ,氮气分子中化学键比氧气分子中的化学键强(填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:
N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.分析两种固氮反应的平衡常数,下列结论正确的是BC.
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:2NO2?N2O4.每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②上述反应达到平衡后四氧化二氮的体积分数为25%,
③达到平衡后,恒温下如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,此时有关反应的V(正)、V(逆)速率的说法正确的是BC
A.都增大 B.都减小 C.V(正)<V(逆)