题目内容
12.按要求写出方程式.(1)碳酸钙和盐酸(写出离子方程式)CaCO3+2H+=Ca2++CO2↑+H2O
(2)氢氧化钡溶液和稀硫酸(写出离子方程式)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(3)氧化铁和稀盐酸反应 (写出离子方程式)Fe2O3+6H+=2Fe3++3H2O
(4)Fe2(SO4)3(写出电离方程式)Fe2(SO4)3=2Fe3++3SO42-
(5)H++OH-═H2O(写出对应的化学方程式)NaOH+HCl=NaCl+H2O
(6)CO32-+2H+═CO2↑+H2O(写出对应的化学方程式)Na2CO3+2HCl=CO2↑+H2O+2NaCl.
分析 (1)碳酸钙和盐酸反应生成氯化钙和二氧化碳;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水;
(3)氧化铁与盐酸反应生成氯化铁和水;
(4)Fe2(SO4)3为强电解质完全电离;
(5)H++OH-=H2O可表示强酸与强碱反应生成可溶性盐和水;
(6)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应.
解答 解:(1)碳酸钙和盐酸反应生成氯化钙和二氧化碳,离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)氧化铁与盐酸反应生成氯化铁和水,其反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(4)硫酸铁是强电解质完全电离;电离方程式为:Fe2(SO4)3=2Fe3++3SO42-,
故答案为:Fe2(SO4)3=2Fe3++3SO42-;
(5)符合离子方程式H++OH-=H2O的反应是强碱强酸稀溶液发生的中和反应生成水和溶于水的盐;化学方程式为:NaOH+HCl=NaCl+H2O,
故答案为:NaOH+HCl=NaCl+H2O.
(6)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,如Na2CO3+2HCl=CO2↑+H2O+2NaCl,
故答案为:Na2CO3+2HCl=CO2↑+H2O+2NaCl.
点评 本题考查了离子方程式书写、电离方程式,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分、注意反应必须遵循客观事实,题目难度不大.

 考前必练系列答案
考前必练系列答案| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
| A. | 葡萄糖 | B. | 甘油 | C. | 多酞 | D. | 氨基酸 |
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),计算△H=-262.7kJ•mol-1.反应原料来自煤的气化.已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1.
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol•L-1,c(H2)=1.4mol•L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol•L-1•min-1.
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表温度(填“温度”或“压强”)判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件
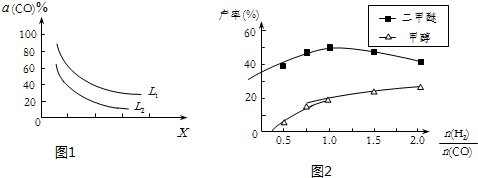
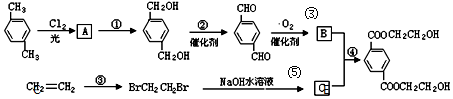
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比$\frac{n({H}_{2})}{n(CO)}$的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小.
| A. | 丙酸和乙酸甲酯 | B. | 蔗糖和麦芽糖 | C. | 麦芽糖和纤维素 | D. | 苯甲酸和苯甲醛 |
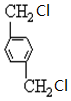 、B、
、B、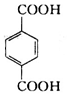 、C.HOCH2CH2OH、
、C.HOCH2CH2OH、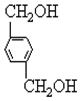 +2NaCl;
+2NaCl; ,反应的化学方程式是
,反应的化学方程式是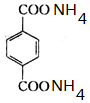 +2H2O.
+2H2O.