题目内容
20.下列反应过程中的能量变化与右图一致的是( )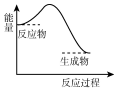
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| C. | Ba(OH)2•8H2O+2NH4Cl$\frac{\underline{\;研磨\;}}{\;}$BaCl2+2NH3↑+10H2O | |
| D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
分析 由图可知,反应物能量大于生成物能量,因此该反应为放热反应,常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、铝热反应、多数的化合反应等,其△H<0.常见的吸热反应:Ba(OH)2•8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等.
解答 解:根据图象可知,反应物总能量大于生成物总能量,该反应为放热反应,
A.反应CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑为吸热反应,故A错误;
B.反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3为放热反应,故B正确;
C.反应Ba(OH)2•8H2O+2NH4Cl$\frac{\underline{\;研磨\;}}{\;}$BaCl2+2NH3↑+10H2O为吸热反应,故C错误;
D.反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑为吸热反应,故D错误;
故选B.
点评 本题考查反应热与焓变的应用,题目难度不大,明确常见反应与能量变化的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
10.下列元素中,金属性最强的是( )
| A. | Na | B. | Mg | C. | Cs | D. | K |
8.下列关于有机化合物的说法正确的是( )
| A. | 2-甲基丁烷也称异丁烷 | |
| B. |  的-溴代物和 的-溴代物和 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| C. | 烷烃 的命名是:3-异丙基己烷 的命名是:3-异丙基己烷 | |
| D. |  与 与  互为同系物 互为同系物 |
15.表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:
(1)画出元素⑧的原子结构示意图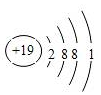
(2)在这些元素中,最活泼的非金属元素是F,最不活泼的元素是Ar(写元素符号 ).
(3)在这些元素的最高价氧化物对应水化物中,碱性最强的是KOH(写化学式),呈两性的氢氧化物是Al(OH)3(写化学式),写出两者之间反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
(4)在⑥与⑨中,化学性质较活泼的是Cl(写元素符号 ),写出可以验证该结论的一个化学反应方式Cl2+2NaBr=Br2+2NaCl.
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |

(2)在这些元素中,最活泼的非金属元素是F,最不活泼的元素是Ar(写元素符号 ).
(3)在这些元素的最高价氧化物对应水化物中,碱性最强的是KOH(写化学式),呈两性的氢氧化物是Al(OH)3(写化学式),写出两者之间反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
(4)在⑥与⑨中,化学性质较活泼的是Cl(写元素符号 ),写出可以验证该结论的一个化学反应方式Cl2+2NaBr=Br2+2NaCl.
5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,溶液中的OH-由负极向正极移动 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
12.为实现实验目的,选用的装置、实验操作均正确的是( )
| 实验目的 | 实验步骤和装置 | |
| A | 验证SO2具有漂白性 | 将SO2通入氢氧化钠的酚酞试液中 |
| B | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
| C | 验证牺牲阳极的阴极保护法 |  往铁电极附近滴加铁氰化钾溶液 |
| D | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的Cu(OH)2,加热3-5min. |
| A. | A | B. | B | C. | C | D. | D |
2.Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是( )
| A. | 氯化物 | B. | 硫酸盐 | C. | 硝酸盐 | D. | 碳酸盐 |
3.下列离子方程式正确的是( )
| A. | 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | |
| B. | 尼泊金酸与碳酸氢钠反应: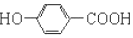 +2HCO3-→ +2HCO3-→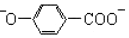 +2CO2↑+2H2O +2CO2↑+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]++2OH$\stackrel{△}{→}$CO32-+2NH4++2Ag↓+2NH3+H2O |