题目内容
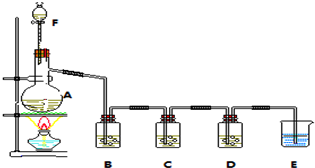
15.某校化学小组学生进行“铁与水蒸气反应”的实验,并探究固体产物成分.(1)反应的化学方程式是3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
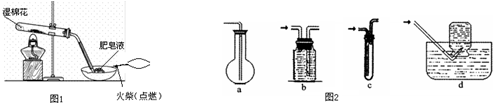
(2)图1装置证明实验中有气体产生的现象是有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸
(3)收集实验中产生的气体,应用图2装置中的bd (选填字母编号).
(4)反应停止冷却后称量,得到固体质量为28.8g.再向固体中加入过量稀盐酸充分反应,并进行如图实验:
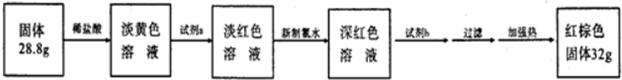
如果向淡黄色溶液中加入一种试剂,产生了蓝色沉淀,则能够确定其中含有Fe2+,写出反应的离子方程式3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl-.
(5)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究.
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:SCN-被过量的氯水氧化;
为了对所提出的假设2进行验证,实验方案是取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2正确,若不变红,则假设2不正确.
(6)根据所给数据,可计算出反应前试管B中铁元素的质量分数为77.8%.
分析 (1)B中Fe与水蒸气高温下反应生成四氧化三铁和氢气;
(2)氢气具有可燃性;
(3)氢气不溶于水,密度比空气的密度小;
(4)由流程可知,混合物溶于酸后,氯气将亚铁离子氧化为铁离子,加试剂b为碱生成氢氧化铁沉淀,最后红棕色固体为氧化铁,亚铁离子具有还原性,可被氯气氧化,检验亚铁离子可利用特征试剂K3[Fe(CN)6];
(5)铁离子可被氧化为高铁酸根离子,或SCN-被过量的氯水氧化;
(6)红褐色固体为氧化铁,其物质的量为$\frac{32g}{160g/mol}$=0.2mol,由Fe原子守恒可知,B中Fe元素的质量为0.2mol×2×56g/mol=22.4g,以此计算.
解答 解:(1)B中Fe与水蒸气高温下反应生成四氧化三铁和氢气,反应为3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑,
故答案为:3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑;
(2)图1装置证明实验中有气体产生的现象是有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸,故答案为:有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸;
(3)氢气不溶于水,密度比空气的密度小,选择排水法及向下排空气法收集,即选择bd,
故答案为:bd;
(4)向淡黄色溶液中加入一种试剂,产生了蓝色沉淀,则能够确定其中含有Fe2+,反应的离子方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;加入新制氯水后溶液红色加深的原因是2Fe2++Cl2=2Fe3++2Cl-,
故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;2Fe2++Cl2=2Fe3++2Cl-;
(5)假设2为SCN-被过量的氯水氧化;假设2进行验证,实验方案是取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2正确,若不变红,则假设2不正确,
故答案为:SCN-被过量的氯水氧化;取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2正确,若不变红,则假设2不正确;
(6)红褐色固体为氧化铁,其物质的量为$\frac{32g}{160g/mol}$=0.2mol,由Fe原子守恒可知,B中Fe元素的质量为0.2mol×2×56g/mol=22.4g,则反应前试管B中铁元素的质量分数为$\frac{22.4g}{28.8g}$×100%=77.8%,
故答案为:77.8%.
点评 本题考查物质的性质实验,为高频考点,把握物质的性质、发生的反应、离子检验、含量计算等为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.

| A. | Na投入到水中:Na+H2O═Na++OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2+ | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
| A. | Ca2+、Na+、SO42-、CO32- | B. | K+、Fe2+、SO42-、MnO4- | ||
| C. | Ba2+、K+、Al3+、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(杂质不与I-发生氧化还原反应)的纯度,过程如下:取试样溶于水,加入过量KI固体,充分反应,有白色沉淀(CuI)产生.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液V mL.(已知:I2+2S2O32-═S4O62-+2I-.)
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
②可选用淀粉作滴定指示剂,滴定终点的现象是:滴入最后一滴Na2S2O3,淀粉由蓝色变成无色且半分钟不变化.
 欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为锥形瓶;
(2)盛装标准盐酸的仪器名称为酸式滴定管;
(3)滴定至终点的颜色变化为溶液由黄色变为橙色且半分钟内不褪色;
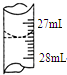
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标
准溶液的体积为26.90mL;
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1052mol/L;(保留四位有效数字)
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.