题目内容
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1L0.1mol•L-1NaHS溶液中,S2-与HS-数目之和为0.1NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 4gD2O与4gH218O含有的中子数均为2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
分析 A.溶液中含有存在硫化氢分子,则二者物质的量之和小于0.1mol;
B.标况下三氧化硫的状态不是气体;
C.二者摩尔质量都是20g/mol,二者都含有10个中子;
D.铁与浓硫酸发生钝化,阻止了反应的继续进行.
解答 解:A.1L0.1mol•L-1NaHS溶液中,根据物料守恒可知S2-、H2O与HS-数目之和为0.1NA,故A错误;
B.标准状况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算,故B错误;
C.4gD2O与4gH218O的物质的量都为:$\frac{4g}{20g/mol}$=0.2mol,二者都含有10个中子,则含有中子数都是0.2mol×10=2mol,含有的中子数均为2NA,故C正确;
D.常温下Fe与浓硫酸发生钝化现象,无法计算生成二氧化硫分子的数目,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题培养了学生的化学计算能力.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
10.下列说法中正确的是( )
| A. | 盐中一定含有金属元素 | B. | 氢化物一定是共价化合物 | ||
| C. | 碱中一定含有氢、氧元素 | D. | 能电离出H+的物质一定是酸 |
11.分子式为C5H8O2,能使溴的CC14溶液褪色且分子中含有一个甲基的羧酸类物质共有(不含立体异构)( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
8.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
15.W、X、Y、Z是短周期元素,在元素周期表中的相对位置如图所示,下列推断正确的是( )
| W | Y | |
| X | Z |
| A. | 若W的氧化物为WO2,则Z的最高价含氧酸一定为H2ZO4 | |
| B. | 若X的单质可作半导体材料,则Y的氢化物的水溶液一定显碱性 | |
| C. | 原子半径大小顺序一定为X>Z>Y>W | |
| D. | 最高正化合价大小顺序一定为Y=Z>X>W |
3.工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下.
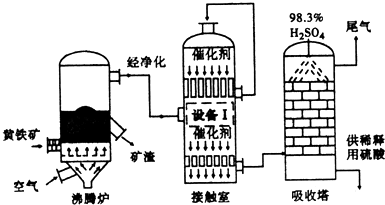
(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
(4)在吸收塔中将SO3转化成硫酸,使用98.3%的硫酸从上方喷淋.而不使用水的理由是防止形成酸雾.吸收塔中填充有许多瓷管,其作用是增加SO3与浓硫酸的接触面,有利于SO3的吸收.
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.

(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.
10.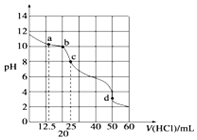 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |