题目内容
 人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:
5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl
①该电池的负极反应式是
②在电池中,Na+不断移动到“水”电池的
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是
(2)2009年10月,中国科学院长春应用化学研究所在甲醇(CH3OH一种可燃物)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的
Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
考点:化学电源新型电池
专题:电化学专题
分析:(1)①负极上失电子发生氧化反应;
②原电池放电时,电解质溶液中阳离子向正极移动;
③根据Na2Mn5O10和转移电子之间的关系式计算.
(2)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③根据甲醇和转移电子之间的关系式计算;
(3)电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,反应还应有KOH参加,依据转化写出电池反应.
②原电池放电时,电解质溶液中阳离子向正极移动;
③根据Na2Mn5O10和转移电子之间的关系式计算.
(2)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③根据甲醇和转移电子之间的关系式计算;
(3)电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,反应还应有KOH参加,依据转化写出电池反应.
解答:
解:(1)①根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,
故答案为:Ag+Cl--e-=AgCl;
②在原电池中阴离子向负极移动,阳离子向正极移动,所以钠离子向正极移动,故答案为:正;
③根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,则外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是2mol,故答案为:2mol.
(2)①据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料甲醇,故答案为:CH3OH;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e-=6H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=
=1.2mol,则转移电子个数为1.2NA,故答案为:1.2;
(3)电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,正极电极反应式为Ag2O2+4e-+2H2O═2Ag+4OH-,负极电极反应式为2Zn-4e-+8OH-═2Zn(OH)42-,反应还应有KOH参加,反应的总方程式为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,
故答案为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag.
故答案为:Ag+Cl--e-=AgCl;
②在原电池中阴离子向负极移动,阳离子向正极移动,所以钠离子向正极移动,故答案为:正;
③根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,则外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是2mol,故答案为:2mol.
(2)①据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料甲醇,故答案为:CH3OH;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e-=6H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
③根据2CH3OH-12e-+2H2O=2CO2+12H+知,甲醇和转移电子之间的关系式得,当6.4g甲醇完全反应生成CO2时,转移电子的物质的量=
| 6.4g |
| 32g/mol |
(3)电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,正极电极反应式为Ag2O2+4e-+2H2O═2Ag+4OH-,负极电极反应式为2Zn-4e-+8OH-═2Zn(OH)42-,反应还应有KOH参加,反应的总方程式为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,
故答案为:Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag.
点评:本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.

练习册系列答案
相关题目
氧化还原反应的实质是( )
| A、分子中的原子重新组合 |
| B、氧元素的得失 |
| C、电子的转移 |
| D、化合价的改变 |
下列有关元素周期表中元素性质的叙述中不正确的是( )
| A、同主族元素从上到下,金属性逐渐增强 |
| B、主族元素的最高正化合价均等于它所在的主族序数 |
| C、同周期的元素(稀有气体例外)的原子半径越小,越难失去电子 |
| D、元素的非金属性越强,其气态氢化物水溶液的酸性越强 |
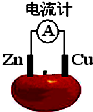 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.

 能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.