题目内容
下列有关元素周期表中元素性质的叙述中不正确的是( )
| A、同主族元素从上到下,金属性逐渐增强 |
| B、主族元素的最高正化合价均等于它所在的主族序数 |
| C、同周期的元素(稀有气体例外)的原子半径越小,越难失去电子 |
| D、元素的非金属性越强,其气态氢化物水溶液的酸性越强 |
考点:位置结构性质的相互关系应用
专题:
分析:A.同一主族元素,元素金属性随着原子序数的增大而增强;
B.主族元素的最高正化合价与其族序数相等;
C.同一周期元素,元素的非金属性随着原子序数的增大而增强,其原子半径随着原子序数的增大而减弱,元素的非金属性越强,其越难失电子;
D.元素非金属性与其氢化物溶液酸性强弱无关.
B.主族元素的最高正化合价与其族序数相等;
C.同一周期元素,元素的非金属性随着原子序数的增大而增强,其原子半径随着原子序数的增大而减弱,元素的非金属性越强,其越难失电子;
D.元素非金属性与其氢化物溶液酸性强弱无关.
解答:
解:A.同一主族元素从上到下,原子失电子能力逐渐增强,所以其金属性逐渐增强,故A正确;
B.主族元素最高正化合价数值等于该原子失去最外层电子数,其最外层电子数与其族序数相等,所以主族元素的最高正化合价均等于它所在的主族序数,故B正确;
C.同周期的元素(稀有气体例外)的原子半径越小,其非金属性越强,其得电子能力越强,所以该元素越难失去电子,故C正确;
D.元素非金属性与其氢化物溶液酸性强弱无关,所以不能根据氢化物溶液酸性强弱确定非金属性强弱,故D错误;
故选D.
B.主族元素最高正化合价数值等于该原子失去最外层电子数,其最外层电子数与其族序数相等,所以主族元素的最高正化合价均等于它所在的主族序数,故B正确;
C.同周期的元素(稀有气体例外)的原子半径越小,其非金属性越强,其得电子能力越强,所以该元素越难失去电子,故C正确;
D.元素非金属性与其氢化物溶液酸性强弱无关,所以不能根据氢化物溶液酸性强弱确定非金属性强弱,故D错误;
故选D.
点评:本题考查了元素周期律,明确同一主族、同一周期元素结构和性质的规律是解本题关键,注意:金属性强弱与失电子难易程度有关,与失电子多少无关,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂.下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是( )
| A、2Na+2H2O=2NaOH+H2↑ |
| B、2H2O=2H2↑+O2↑ |
| C、2F2+2H2O=4HF+O2 |
| D、Cl2+H2O=HCl+HClO |
 如图各装置不能达到实验目的是( )
如图各装置不能达到实验目的是( )| A、装置①可制取少量蒸馏水 |
| B、装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C、装置③可用于排空气法收集NO气体 |
| D、装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
将下列各组物质按酸、碱、盐分类顺次排列.其中正确的是( )
| A、硫酸,纯碱,醋酸钠 |
| B、硝酸,烧碱,纯碱 |
| C、盐酸,乙醇,醋酸钠 |
| D、盐酸,熟石灰,苛性钠 |
除去括号内杂质所用试剂和方法不正确的是( )
| A、Cu(Fe)--加盐酸,过滤 |
| B、乙醇(水)--加生石灰,蒸馏 |
| C、KNO3溶液(KCl)--降温结晶,过滤 |
| D、CO2(HCl)--饱和NaOH溶液,洗气 |
 某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )| A、该反应的△H>0 |
| B、E1表示正反应的活化能 |
| C、E2表示逆反应的活化能 |
| D、使用催化剂降低正反应的活化能,不能降低逆反应的活化能 |
下列关于胶体的叙述中正确的是( )
| A、液溶胶是一种液态混合物属于分散系的一种 |
| B、直径介于1 nm~10 nm之间的微粒称为胶体 |
| C、胶体的本质特征是发生丁达尔效应 |
| D、用过滤器可以将胶体和溶液分开 |
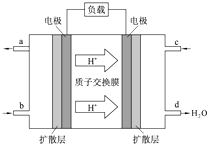 人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: