题目内容
(Ⅰ)A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO3-、CO32-中不同的阴、阳离子所组成.经实验A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡.则A为 、B为 .将B和C的溶液混合反应的离子方程式为: .
(Ⅱ)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
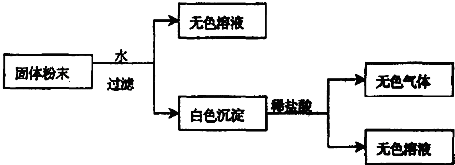
从实验可以判断,该固体粉末中一定不含有 ,它的组成可能是 或 .
(Ⅱ)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:

从实验可以判断,该固体粉末中一定不含有
考点:物质的检验和鉴别的实验方案设计,几组未知物的检验
专题:物质检验鉴别题
分析:(Ⅰ)先根据离子共存判断离子之间的组合:Ag+只能结合NO3-形成硝酸银、剩下的离子中Ba2+只能结合Cl-形成氯化钡、最后的离子结合形成碳酸钠,然后根据A、B能够与盐酸反应的现象判断A、B组成,从而明确A、B、C的名称,书写B和C的溶液混合反应的化学方程式;
(Ⅱ)固体粉CaCO3、Na2SO4、BaCl2、CuSO4溶于水有沉淀、无色溶液,则能排除CuSO4,因为CuSO4溶于水显蓝色;难溶物溶于稀盐酸,说明一定含有碳酸钙,硫酸钠和氯化钡不会同时存在.
(Ⅱ)固体粉CaCO3、Na2SO4、BaCl2、CuSO4溶于水有沉淀、无色溶液,则能排除CuSO4,因为CuSO4溶于水显蓝色;难溶物溶于稀盐酸,说明一定含有碳酸钙,硫酸钠和氯化钡不会同时存在.
解答:
解:(Ⅰ)A、B、C为三种无色可溶盐,则Ag+只能结合NO3-形成AgNO3、剩下的离子中Ba2+只能结合Cl-形成BaCl2,另一种物质则为Na2CO3;
A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,则A为AgNO3;B与盐酸产生气泡,所以B为Na2CO3,C不与盐酸反应,则C为BaCl2,将B和C的溶液混合反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,即Ba2++CO32-=BaCO3↓.
故答案为:AgNO3;Na2CO3;Ba2++CO32-=BaCO3↓.
(Ⅱ)固体粉末由CaCO3、Na2SO4、BaCl2、CuSO4中的两种物质组成,取样品加水,出现白色沉淀,该白色沉淀能够溶于稀盐酸,则该固体粉末中一定含有CaCO3,且硫酸钠与氯化钡不会同时存在;得到无色溶液,该固体粉末中一定不含有CuSO4,因为CuSO4溶于水显蓝色,
根据分析可知,溶液中一定不存在CuSO4,该固体粉末含有的三种物质可能为:CaCO3、Na2SO4、KNO3 或CaCO3、BaCl2、KNO3,
故答案为:CuSO4;CaCO3、Na2SO4、KNO3;CaCO3、BaCl2、KNO3.
A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,则A为AgNO3;B与盐酸产生气泡,所以B为Na2CO3,C不与盐酸反应,则C为BaCl2,将B和C的溶液混合反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,即Ba2++CO32-=BaCO3↓.
故答案为:AgNO3;Na2CO3;Ba2++CO32-=BaCO3↓.
(Ⅱ)固体粉末由CaCO3、Na2SO4、BaCl2、CuSO4中的两种物质组成,取样品加水,出现白色沉淀,该白色沉淀能够溶于稀盐酸,则该固体粉末中一定含有CaCO3,且硫酸钠与氯化钡不会同时存在;得到无色溶液,该固体粉末中一定不含有CuSO4,因为CuSO4溶于水显蓝色,
根据分析可知,溶液中一定不存在CuSO4,该固体粉末含有的三种物质可能为:CaCO3、Na2SO4、KNO3 或CaCO3、BaCl2、KNO3,
故答案为:CuSO4;CaCO3、Na2SO4、KNO3;CaCO3、BaCl2、KNO3.
点评:本题考查了未知物检验、常见有机物的推断,题目难度中等,注意掌握常见未知物检验的性质及检验方法.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
将铜粉放入稀硫酸中,加热无明显现象发生.但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是( )
| A、Fe2(SO4)3 |
| B、ZnSO4 |
| C、KNO3 |
| D、NaCl |
下列各组离子中电子层结构相同的是( )
| A、S2-、Cl-、K+ |
| B、Na+、Cl-、Mg2+ |
| C、Cl-、Mg2+、Al3+ |
| D、Li+、O2-、F- |
下列元素的第一电离能依次减小的是( )
| A、H、Li、Na、K |
| B、I、Br、Cl、F |
| C、Na、Mg、Al、Si |
| D、Si、Al、Mg、Na |
经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.下列判断正确的是( )
| A、AlCl3为离子化合物 |
| B、P 与Cl可形成共价键 |
| C、SiCl4为共价化合物 |
| D、K与Mg 形成共价键 |
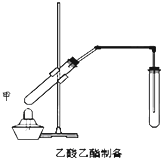 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: