题目内容
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为 ;在熔点很高的两种常见单质中,X的杂化方式分别为 、 .
(2)14g乙的单质分子中π键的个数为 .
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第 电离能.
(4)戊的基态原子有 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为 .距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用含ρ、NA的计算式表示)
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为 .
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为
(2)14g乙的单质分子中π键的个数为
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第
(4)戊的基态原子有

(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:甲、乙、丙原子序数依次递增,甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2,故甲、乙、丙分别是C、N、O,戊元素是周期表中ds区的第一种元素,所以戊为Cu,丁与戊原子序数相差18,则丁为Na.
(1)碳单质中熔点较低的是C60,分子密堆积,每个分子周围紧邻的分子数为12个.熔点较高的有金刚石和石墨,金刚石中碳原子是sp3杂化,而石墨层状结构,碳原子是sp2杂化;
(2)氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气是0.5mol,所以分子中π键的个数为NA;
(3)钠是第IA元素,失去1个电子后,就达到稳定结构,所以电离能突增应出现在第二电离能;
(4)铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道;
(5)根据晶胞(Na2O)结构可知,顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体.该晶胞中含有4个阴离子;
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对.
(1)碳单质中熔点较低的是C60,分子密堆积,每个分子周围紧邻的分子数为12个.熔点较高的有金刚石和石墨,金刚石中碳原子是sp3杂化,而石墨层状结构,碳原子是sp2杂化;
(2)氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气是0.5mol,所以分子中π键的个数为NA;
(3)钠是第IA元素,失去1个电子后,就达到稳定结构,所以电离能突增应出现在第二电离能;
(4)铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道;
(5)根据晶胞(Na2O)结构可知,顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体.该晶胞中含有4个阴离子;
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对.
解答:
解:由分析知甲、乙、丙、丁、戊分别是C、N、O、Na、Cu元素,
(1)碳单质中熔点较低的是C60,分子密堆积,晶体结构类似于干冰,每个分子周围紧邻的分子数=3×8×
=12个.
熔点较高的有金刚石和石墨,金刚石中碳原子全部形成4个共价键,所以是sp3杂化,而石墨层状结构,碳原子形成3个共价键,所以是sp2杂化.
故答案为:12;sp2;sp3;
(2)氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气物质的量=
=0.5mol,所以14g氮气分子中π键的个数=2×0.5NA=NA,
故答案为:NA.
(3)钠是第IA元素,最外层有1个电子,失去1个电子后,就达到稳定结构,再失电子会很困难,所以电离能突增应出现在第二电离能,故答案为:二;
(4)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,可以看出铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道,故答案为:3;
(5)根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体.该晶胞中含有4个阴离子,所以有
=4,解得a=
.
故答案为:8;正方体(立方体);
;
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对,CO32-含有的电子对数=3+
=3,NO3-含有的电子对数=3+
=3,所以都是平面三角形结构,
故答案为:平面三角形.
(1)碳单质中熔点较低的是C60,分子密堆积,晶体结构类似于干冰,每个分子周围紧邻的分子数=3×8×
| 1 |
| 2 |
熔点较高的有金刚石和石墨,金刚石中碳原子全部形成4个共价键,所以是sp3杂化,而石墨层状结构,碳原子形成3个共价键,所以是sp2杂化.
故答案为:12;sp2;sp3;
(2)氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气物质的量=
| 14g |
| 28g/mol |
故答案为:NA.
(3)钠是第IA元素,最外层有1个电子,失去1个电子后,就达到稳定结构,再失电子会很困难,所以电离能突增应出现在第二电离能,故答案为:二;
(4)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,可以看出铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道,故答案为:3;
(5)根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体.该晶胞中含有4个阴离子,所以有
| a3×ρ×NA |
| 62 |
| 3 |
| ||
故答案为:8;正方体(立方体);
| 3 |
| ||
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对,CO32-含有的电子对数=3+
| 4+2-2×3 |
| 2 |
| 5+1-2×3 |
| 2 |
故答案为:平面三角形.
点评:本题考查了晶胞的计算、核外电子排布、原子轨道杂化方式等内容,综合性较强,难度较大,注意利用均摊法解答晶胞的计算.

练习册系列答案
相关题目
下列说法正确的是( )
| A、所有的放热反应都能在常温常压下自发进行 |
| B、Ba(OH)2?8H2O与NH4Cl反应属于放热反应 |
| C、天然气燃烧时,其化学能全部转化为热能 |
| D、反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
(1)P和S (2)Mg和Ca (3)Al和Si三组原子中,分别找出第一电离能较高的原子,这三种原子的原子序数之和是( )
| A、40 | B、48 | C、41 | D、49 |
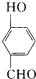 比
比 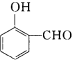 的沸点
的沸点