题目内容
经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.下列判断正确的是( )
| A、AlCl3为离子化合物 |
| B、P 与Cl可形成共价键 |
| C、SiCl4为共价化合物 |
| D、K与Mg 形成共价键 |
考点:元素电离能、电负性的含义及应用,化学键
专题:化学键与晶体结构
分析:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,根据形成化合物的两种元素电负性差确定化合物类型.
解答:
解:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,
A.Cl元素电负性为3.16、Al元素的电负性为1.61,二者之差为1.55<1.7,所以属于共价化合物,故A错误;
B.Cl元素电负性为3.16、P元素的电负性为2.19,二者之差为0.97<1.7,所以属于共价化合物,故B正确;
C.Cl元素电负性为3.16、Si元素的电负性为1.90,二者之差为1.26<1.7,所以属于共价化合物,故C正确;
D.K的电负性为0.82、Mg的电负性为1.31,虽然二者之差小于1.7,但K、Mg不能形成化合物,只能形成合金,故D错误;
故选BC.
A.Cl元素电负性为3.16、Al元素的电负性为1.61,二者之差为1.55<1.7,所以属于共价化合物,故A错误;
B.Cl元素电负性为3.16、P元素的电负性为2.19,二者之差为0.97<1.7,所以属于共价化合物,故B正确;
C.Cl元素电负性为3.16、Si元素的电负性为1.90,二者之差为1.26<1.7,所以属于共价化合物,故C正确;
D.K的电负性为0.82、Mg的电负性为1.31,虽然二者之差小于1.7,但K、Mg不能形成化合物,只能形成合金,故D错误;
故选BC.
点评:本题考查共价化合物和离子化合物的判断,侧重考查学生学以致用能力,根据形成化合物元素电负性的差进行判断即可,注意不能根据是否含有金属元素判断是否是离子化合物,为易错点.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
(1)P和S (2)Mg和Ca (3)Al和Si三组原子中,分别找出第一电离能较高的原子,这三种原子的原子序数之和是( )
| A、40 | B、48 | C、41 | D、49 |

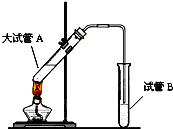 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题: 如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.
如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.