题目内容
15.下列结论错误的个数是( )①微粒半径:r(K+)>r(S2-)
②氢化物的稳定性:HCl>H2S
③还原性:Cl->I-
④氧化性:Cl2>S
⑤酸性:H2SO4>H3PO4
⑥非金属性:O>N
⑦金属性:Mg<Ca.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①具有相同电子排布的离子,原子序数大的离子半径小;
②非金属性越强,氢化物越稳定;
③非金属性越强,对应阴离子还原性越弱;
④非金属性越强,对应单质的氧化性越强;
⑤非金属性越强,最高价含氧酸的酸性越强;
⑥同周期从左向右非金属性增强;
⑦同主族从上到下金属性增强.
解答 解:①具有相同电子排布的离子,原子序数大的离子半径小,则微粒半径:r(K+)<r(S2-),故错误;
②非金属性Cl>S,氢化物的稳定性为HCl>H2S,故正确;
③非金属性Cl>I,对应阴离子还原性为Cl-<I-,故错误;
④非金属性Cl>S,对应单质的氧化性为Cl2>S,故正确;
⑤非金属性S>P,最高价含氧酸的酸性为H2SO4>H3PO4,故正确;
⑥同周期从左向右非金属性增强,则非金属性:O>N,故正确;
⑦同主族从上到下金属性增强,则金属性:Mg<Ca,故正确;
故选B.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.工业上以锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂.其部分工业流程如图:
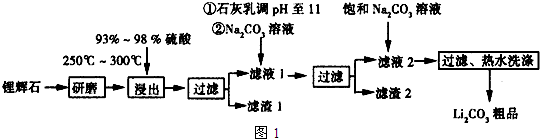
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
(1)从滤渣1中分离出Al2O3部分的流程如图2所示,括号表示加入的试剂,方框表示所得的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+
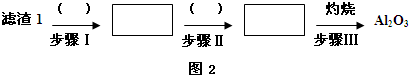
请写出Al2O3和Na2CO3固体在高温下反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)Ca(OH)2?Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀.
(3)最后一个步骤中,用“热水洗涤”的原因是减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Li2CO3+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

请写出Al2O3和Na2CO3固体在高温下反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)Ca(OH)2?Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀.
(3)最后一个步骤中,用“热水洗涤”的原因是减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Li2CO3+NH3+2H2O.
6.氮分子中的化学键是( )
| A. | 3个σ键 | B. | 1个σ键,2个π键 | C. | 3个π键 | D. | 1个σ键,1个π键 |
10.下列电子式书写正确的是( )
| A. | 氯化钠  | B. | 氨气  | C. | NH4Cl的电子式 | D. | 硫化钠 |
20.下列实验不能获得成功的是( )
①将水和溴乙烷混合加热制乙醇
②将乙醇与浓硫酸共热至140℃来制取乙烯
③用电石和水制取乙炔
④苯、浓溴水和铁粉混合,反应后可制得溴苯
⑤将乙醇和3mol•L -1的硫酸按体积比1:3混和共热至170℃制乙烯.
①将水和溴乙烷混合加热制乙醇
②将乙醇与浓硫酸共热至140℃来制取乙烯
③用电石和水制取乙炔
④苯、浓溴水和铁粉混合,反应后可制得溴苯
⑤将乙醇和3mol•L -1的硫酸按体积比1:3混和共热至170℃制乙烯.
| A. | 只有②④⑤ | B. | 只有①②④ | C. | 只有②④ | D. | 只有①②④⑤ |
7.下列分子中,核磁共振氢谱中有3个峰的是( )
| A. | 一氯甲烷 | B. | 溴乙烷 | C. | 1-氯丙烷 | D. | 邻氯甲苯 |
4.下列单质分子中,键长最长,键能最小的是( )
| A. | H2 | B. | Cl2 | C. | Br2 | D. | I2 |
5.明•于谦诗:“凿开混沌得乌金,藏蓄阳和意最深.爝火燃回春浩浩,洪炉照破夜沉沉.”这里“乌金”指的是( )
| A. | 煤 | B. | 磁铁矿 | C. | 石油 | D. | 金 |
 维生素C的结构简式如图:其分子式为C6H8O6,所含的官能团是醇羟基、碳碳双键和酯基,判断维生素C能(填“能”或“否”)溶于水.
维生素C的结构简式如图:其分子式为C6H8O6,所含的官能团是醇羟基、碳碳双键和酯基,判断维生素C能(填“能”或“否”)溶于水.