题目内容
7.下列分子中,核磁共振氢谱中有3个峰的是( )| A. | 一氯甲烷 | B. | 溴乙烷 | C. | 1-氯丙烷 | D. | 邻氯甲苯 |
分析 根据有机物分子中有几种H原子,核磁共振氢谱有几种吸收峰,结合等效氢判断.
解答 解:A.一氯甲烷CH3Cl,分子中只有一种氢原子,核磁共振氢谱一种,故A不符合;
B.溴乙烷CH3CH2Br,分子中含有两种氢原子,核磁共振氢谱两种,故B不符合;
C.1-氯丙烷CH3CH2CH2Cl,分子中含有两种氢原子,核磁共振氢谱三种,故C符合;
D.邻氯甲苯分子中含有五种氢原子,核磁共振氢谱五种,故D不符合;
故选C.
点评 本题考查核磁共振氢谱,难度不大,清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数是解题的关键.

练习册系列答案
相关题目
11.关于下列装置说法正确的是( )
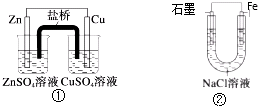

| A. | 装置②中的Fe发生析氢腐蚀 | |
| B. | 装置①中,Zn为负极,发生还原反应 | |
| C. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| D. | 装置②中电子由Fe流向石墨,然后再经溶液流向Fe |
18.如图是一些常见有机物的转化关系,下列说法正确的是( )
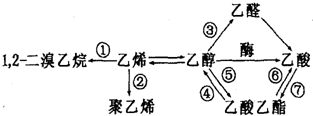

| A. | 反应①需要的条件是光照 | B. | 反应②的反应类型是加聚反应 | ||
| C. | 反应⑤⑦需要稀硫酸做催化剂 | D. | 反应③④⑤⑥⑦都属于取代反应 |
15.下列结论错误的个数是( )
①微粒半径:r(K+)>r(S2-)
②氢化物的稳定性:HCl>H2S
③还原性:Cl->I-
④氧化性:Cl2>S
⑤酸性:H2SO4>H3PO4
⑥非金属性:O>N
⑦金属性:Mg<Ca.
①微粒半径:r(K+)>r(S2-)
②氢化物的稳定性:HCl>H2S
③还原性:Cl->I-
④氧化性:Cl2>S
⑤酸性:H2SO4>H3PO4
⑥非金属性:O>N
⑦金属性:Mg<Ca.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
2.以下指定溶液中有关离子的物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)>c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液的物质的量浓度:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa两溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1的NaHA溶液,测得pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
12.下列化学用语的书写,不正确的是( )
| A. | 溴化钠的电子式: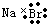 | B. | 硫原子的结构示意图: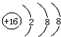 | ||
| C. | 氢气分子的电子式: | D. | 水的分子式为H2O |
19.下列反应的生成物为纯净物的是( )
| A. | CH4和Cl2光照 | B. | 甲苯与液溴发生取代反应 | ||
| C. | CH2=CH-CH3与HCl加成产物 | D. | 乙烯和氯化氢加成 |
17.CoCl2•6H20是一种陶瓷着色剂.利用水钴矿[主要成分为Co203、Co(OH)3,还含少量Fe203、Al203、MnO等]制取CoCl2•6H20的工艺流程如图1:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co(OH)3发生反应的离子方程式2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,则a的范围是5.2≤PH<7.6.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解;
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0〜2.5 B.3.0〜3.5 C.4.0〜4.5 D.5.0〜5.5
(6)操作1为蒸发浓缩、冷却结晶、过滤.
(7)实验室用足量的浓盐酸完全溶解一定量的钴的氧化物Cox0y(其中钴的化合价为+2、+3),若得到含13gCoCl2的溶液并产生标准状况下448mL的黄绿色气体,则y:x=6:5.

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co(OH)3发生反应的离子方程式2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,则a的范围是5.2≤PH<7.6.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解;
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0〜2.5 B.3.0〜3.5 C.4.0〜4.5 D.5.0〜5.5
(6)操作1为蒸发浓缩、冷却结晶、过滤.
(7)实验室用足量的浓盐酸完全溶解一定量的钴的氧化物Cox0y(其中钴的化合价为+2、+3),若得到含13gCoCl2的溶液并产生标准状况下448mL的黄绿色气体,则y:x=6:5.