题目内容
下列最简式中,不需要知道对应物质的相对分子质量即可确定其分子式的是( )
| A、C3H4 |
| B、CH |
| C、CH2 |
| D、C2H5O |
考点:有机物实验式和分子式的确定
专题:有机化学基础
分析:因为碳氢化合物中碳成4条键,所以氢原子数必定是偶数,而且根据烷烃通式可得,最多氢原子数=2n+2(n是碳原子数),据此分析.
解答:
解:A.最简式为C3H4,可以是C3H4或C6H8或C9H12等,故A错误;
B.最简式为CH,可以是C2H2或C4H4(环丁二烯)或C8H8(苯乙烯),故B错误;
C.任何烯烃最简式都是CH2,故C错误;
D.最简式为C2H5O,碳原子扩大1倍为是C4H10O2,氢原子已饱和,只有一种分子,故D正确
故选D.
B.最简式为CH,可以是C2H2或C4H4(环丁二烯)或C8H8(苯乙烯),故B错误;
C.任何烯烃最简式都是CH2,故C错误;
D.最简式为C2H5O,碳原子扩大1倍为是C4H10O2,氢原子已饱和,只有一种分子,故D正确
故选D.
点评:本题考查了根据实验式确定分子式,中等难度.碳成4条键,氢原子数必定是偶数,氢原子数最多为2n+2(n是碳原子数)是判断依据.

练习册系列答案
相关题目
甲醇燃料电池的电池反应为:2CH3OH+3O2
2CO32-+6H2O,则下列说法不正确的是( )
| 放电 |
| 充电 |
| A、充电时,电能转化为化学能 |
| B、充电时,电解质溶液中pH逐渐增大 |
| C、放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D、放电时,负极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O |
下列有关物质的性质和应用的说法均正确的是( )
| A、氢氟酸能与二氧化硅反应,可用于刻蚀玻璃 |
| B、纯碱能与盐酸反应,可用于治疗胃酸过多 |
| C、BaCO3、BaSO4都难溶于水,均可用做钡餐 |
| D、MgO、Al2O3具有很高的熔点,均可用于制造熔融烧碱的坩埚 |
下列反应既属于离子反应,又是氧化还原反应的是( )
| A、NaOH溶液与盐酸中和 |
| B、分解氯酸钾制氧气 |
| C、Zn与CuSO4 溶液的反应 |
| D、钠与水反应 |
T℃时在2L密闭容器中使x(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图2所示.则下列结论正确的是( )
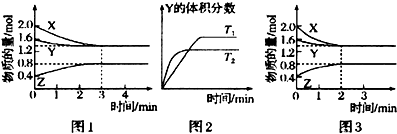

| A、容器中发生的反应可表示为:4X(g)+Y(g)═2Z(g) |
| B、反应进行的前3min内,用x表示的反应速率V(X)=0.3mol/(L?min) |
| C、升高温度,反应的化学平衡常数K增大 |
| D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
人工合成化合物NH5 可改写成NH4H,能和水反应:NH5+H2O═NH3H2O+H2↑.下列说法正确的是( )
| A、NH5属于离子化合物,该反应中水做氧化剂 |
| B、该反应属于氧化还原反应,NH5既是氧化剂又是还原剂 |
| C、该反应不属于氧化还原反应,属于复分解反应 |
| D、标准状况下每生成22.4LH2时,转移2NA电子 |
室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中溶液的描述正确的是( )
| A、溶液的体积10V甲≥V乙 |
| B、水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D、若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |
已知反应:
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
| A、FeCl3>I2>Cl2>H2SO4 |
| B、FeCl2>FeCl3>Cl2>I2 |
| C、Cl2>FeCl3>I2>H2SO4 |
| D、Cl2>H2SO4>I2>FeCl3 |