题目内容
已知反应:
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
| A、FeCl3>I2>Cl2>H2SO4 |
| B、FeCl2>FeCl3>Cl2>I2 |
| C、Cl2>FeCl3>I2>H2SO4 |
| D、Cl2>H2SO4>I2>FeCl3 |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此分析解答.
解答:
解:2FeCl3+2KI=2FeCl2+2KCl+I2中,铁元素化合价降低,所以氯化铁作氧化剂,碘化钾作还原剂,氧化产物是碘单质,则氧化性FeCl3>I2,
2FeCl2+Cl2=2FeCl3中,氯元素化合价降低,铁元素化合价升高,所以氯气是氧化剂,氯化亚铁是还原剂,氯化铁是氧化产物和还原产物,所以氧化性Cl2>FeCl3;
I2+SO2+2H2O═H2SO4+2HI,I元素的化合价降低,S元素的化合价升高,所以碘单质是氧化剂,硫酸是氧化产物,所以则氧化性I2>H2SO4.
则这四种物质的氧化性大小顺序是:Cl2>FeCl3>I2>H2SO4.
故选C.
2FeCl2+Cl2=2FeCl3中,氯元素化合价降低,铁元素化合价升高,所以氯气是氧化剂,氯化亚铁是还原剂,氯化铁是氧化产物和还原产物,所以氧化性Cl2>FeCl3;
I2+SO2+2H2O═H2SO4+2HI,I元素的化合价降低,S元素的化合价升高,所以碘单质是氧化剂,硫酸是氧化产物,所以则氧化性I2>H2SO4.
则这四种物质的氧化性大小顺序是:Cl2>FeCl3>I2>H2SO4.
故选C.
点评:本题考查了还原性强弱的比较,明确还原剂和还原产物的判断是解本题关键,难度不大.

练习册系列答案
相关题目
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池.常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为:LaNi5H6+6NiO(OH)
LaNi5+6Ni(OH)2,下列说法正确的是( )
| 放电 |
| 充电 |
| A、充电时储氢合金作阳极 |
| B、放电时每转移6mol电子,有6mol NiO(OH)被氧化 |
| C、充电时阳极周围PH增大 |
| D、放电时负极反应:LaNi5H6+6OH--6e-═LaNi5+6H2O |
下列最简式中,不需要知道对应物质的相对分子质量即可确定其分子式的是( )
| A、C3H4 |
| B、CH |
| C、CH2 |
| D、C2H5O |
下列有机物命名正确的是( )
| A、H2N-CH2COOH 氨基乙酸 |
B、 2-二氯丙烷 2-二氯丙烷 |
C、 2-甲基丙醇 2-甲基丙醇 |
| D、C17H33COOH 硬脂酸 |
下列叙述中不正确的是( )
| A、向氯化钙溶液中通入少量CO2,有白色沉淀CaCO3生成 |
| B、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| C、向NaAlO2溶液中通入过量CO2,有白色胶状沉淀析出 |
| D、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下生成CO2体积比为53:42 |
对于实验的描述正确的是( )
A、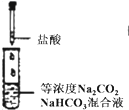 逐滴滴加稀盐酸时,试管中立即产生大量气泡 |
B、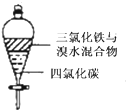 充分振荡后静置,下层溶液为橙红色,上层无色 |
C、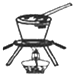 从饱和食盐水中提取NaCl晶体 |
D、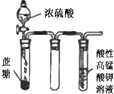 酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
下列化学式只能表示一种纯净物的是( )
| A、CF2Cl2 |
| B、C3H6 |
| C、C6H12O6 |
| D、C2H6O |
标准状况下,某气态有机物密度为3.125g/L,则该有机物的最简式可能是( )
| A、CH |
| B、CH2 |
| C、CH3 |
| D、CH2O |