题目内容
20.下列物质不能通过化合反应制得的是( )| A. | FeCl2 | B. | Mg3N2 | C. | Fe(OH)3 | D. | BaSO4 |
分析 A.Fe与氯化铁反应生成氯化亚铁;
B.Mg与氮气反应生成氮化镁;
C.氢氧化亚铁、氧气、水反应生成氢氧化铁;
D.硫酸钡可利用复分解反应得到.
解答 解:A.Fe与氯化铁反应生成氯化亚铁,为化合反应,故A不选;
B.Mg与氮气反应生成氮化镁,为化合反应,故B不选;
C.氢氧化亚铁、氧气、水反应生成氢氧化铁,为化合反应,故C不选;
D.硫酸钡可利用复分解反应得到,不能利用化合反应生成硫酸钡,故D选;
故选D.
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意化合反应的限制条件,题目难度不大.

练习册系列答案
相关题目
11.下列有关硫元素及其化合物的表示正确的是( )
| A. | 质子数为16、中子数为17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫离子(S2-)的结构示意图: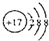 | |
| C. | 二硫化碳分子的结构式:S=C=S | |
| D. | 硫化氢分子的电子式: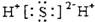 |
8.将固体NH 4I置于密闭容器中,在某温度下发生下列反应:①NH 4I(s)?NH 3(g)+HI(g),②2HI(g)?H 2(g)+I 2(g),当反应达到平衡时,测得c(H 2)=0.5mol/L,c(HI)=4mol/L,则反应①的平衡常数为( )
| A. | 4(mol/L) 2 | B. | 16(mol/L) 2 | C. | 20(mol/L) 2 | D. | 25(mol/L) 2 |
15.电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO${\;}_{3}^{-}$的原理如图所示,下列说法不正确的是( )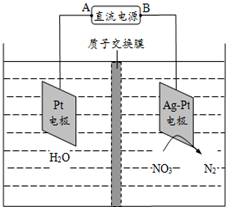

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 该电解池的总反应方程式为:2H2O+4NO3-$\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
5.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向酸性KMnO4溶液中滴加足量H2O2 | 溶液的紫红色消失 | 双氧水有漂白性 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向某无色溶液中滴加足量稀盐酸 | 产生白色沉淀 | 该无色溶液中一定存在Ag+ |
| A. | A | B. | B | C. | C | D. | D |
12.在实验探究课上,同学们积极思考,涉及以下实验方案用以验证浓硫酸的吸水性,其中在理论上可行的方案有几种( )
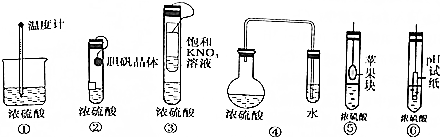

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.三氟化氮(NF3)在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列判断正确的是( )
| A. | 反应中NF3是氧化剂,H2O是还原剂 | |
| B. | 反应中被氧化与被还原的原子物质的量之比为2:1 | |
| C. | 若反应中生成0.2molHNO3,则反应共转移0.4mol电子 | |
| D. | NF3在潮湿空气中泄漏会产生红棕色气体 |
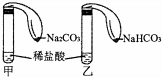 为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).
为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).