题目内容
14.某研究性学习小组利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.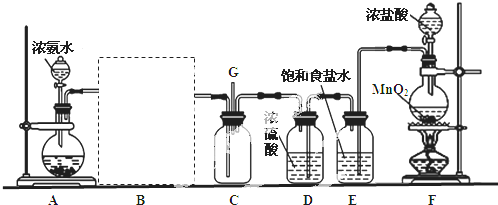
请回答下列问题:
(1)为了快速制备氨气,装置A中烧瓶内的固体可以是③④(填序号).
①二氧化硅 ②过氧化钠 ③生石灰 ④氢氧化钠固体
(2)装置F中发生反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)装置D和E的位置不能(填“能”或“不能”)调换,装置E的作用是:除去氯气中混有的HCl.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出发生反应的化学方程式:3Cl2+8NH3=6NH4Cl+N2.
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理?将尾气通入NaOH溶液中.
分析 (1)生石灰与水反应生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,能够促进氨气的挥发;过氧化钠溶于水生成氢氧化钠的同时生成氧气;
(2)二氧化锰在加热条件下能够氧化盐酸生成氯化锰、氯气和水;
(3)制取的氯气中含有氯化氢、水蒸气,要制取纯净干燥氯气,应先除去氯化氢再除去水蒸气;氯气在饱和食盐水中溶解度不大,氯化氢易溶于饱和食盐水;
(4)氨气和氯化氢气体反应生成白烟氯化铵,根据元素守恒判断另一种物质;
(5)根据氯气的性质选取尾气处理试剂.
解答 解:(1)浓氨水中存在平衡:NH4++OH-?NH3•H2O NH3+H2O,加热或者加热碱性物质能够促进平衡正向移动,有利于氨气的挥发,而生石灰与水反应生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,氢氧化钙、氢氧化钠溶于水电离产生氢氧根离子,促进平衡向正方向移动,有利于氨气的挥发,过氧化钠和水反应生成氢氧化钠和氧气,制取的氨气中混有氧气,所以选择③④,
故选:③④;
(2)二氧化锰在加热条件下能够氧化盐酸生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)要制取干燥纯净的氯气,应先通过盛有饱和食盐水的洗气瓶除去氯化氢,然后通过浓硫酸除去水,若颠倒顺序则不能除去水蒸汽;
故答案为:不能;除去氯气中混有的HCl;
(4)氨气和氯化氢气体反应生成白烟氯化铵,另一生成物是空气的主要成分之一,根据元素守恒知,另一种物质是氮气,所以反应方程式为:3Cl2+8NH3=N2+6NH4Cl,
故答案为:3Cl2+8NH3=N2+6NH4Cl;
(5)未反应的氯气能和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,所以尾气中的氯气可用氢氧化钠溶液吸收,
故答案为:将尾气通入NaOH溶液中.
点评 本题考查气体的制备和性质实验,综合考查了氯气、氨气的制备和性质,熟悉气体制备原理是解题关键,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 称取18.0g固体,在空气中充分灼烧,质量增加1.6g;另取18.0g固体溶于足量稀盐酸,充分反应后,得到标况下气体3.36L(气体全部逸出),说明固体中一定含NaCl | |
| B. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| C. | 取一定量固体,溶解,向溶液中滴加足量盐酸溶液,观察到有气体产生,将产生的气体通入澄清石灰水中变浑浊,说明原固体中一定含有Na2CO3 | |
| D. | 取一定量固体,溶解,向溶液中滴加适量Ca(NO3)2 溶液,观察到产生白色沉淀,说明原固体中一定含有Na2CO3 |
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、NH4+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.1mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
| A. | 氢氧化亚铁 | B. | 过氧化钠 | C. | 镁条 | D. | 氯水 |
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
| A. | 溶液甲的 pH>7 | |
| B. | 对溶液甲进行微热,K1、K2 同时增大 | |
| C. | 若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大 | |
| D. | 若在溶液甲中加入 5 mL 0.1 mol•L-1 的盐酸,则溶液中醋酸的 K1 会变大 |
| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
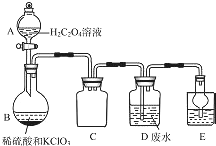 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题: