题目内容
11.一份由氧化镁、氧化铝、二氧化硅和氧化铁组成的混合物粉末,先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )| A. | 该混合粉末从组成看,其成分皆是碱性氧化物 | |
| B. | 溶液Y 中2n(Mg2+)<n(Cl-)<3n(Fe3+) | |
| C. | 沉淀X的成分为二氧化硅 | |
| D. | 在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁和氢氧化镁 |
分析 四种氧化物中,SiO2为酸性氧化物,MgO、Fe2O3属于碱性氧化物,Al2O3属于两性氧化物,溶于盐酸生成MgCl2、AlCl3、FeCl3,溶液中的阳离子主要是Mg2+、Al3+、Fe3+、H+,SiO2属于酸性氧化物,不溶于盐酸,因此过滤出的沉淀是SiO2,以此解答该题.
解答 解:四种氧化物中,SiO2为酸性氧化物,MgO、Fe2O3属于碱性氧化物,Al2O3属于两性氧化物,溶于盐酸生成MgCl2、AlCl3、FeCl3,溶液中的阳离子主要是Mg2+、Al3+、Fe3+、H+,SiO2属于酸性氧化物,不溶于盐酸,因此过滤出的沉淀是SiO2,
A、SiO2为酸性氧化物,故A错误;
B、不知氧化物的量的关系,所以无法确定三种离子的量的关系,但根据电荷守恒,氯离子的浓度应最大,故B错误;
C、过滤出的沉淀是SiO2,故C正确;
D、在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁、氢氧化镁和氢氧化铝,故D错误;
故选C.
点评 本题考查常见金属氧化物的性质,为高考常见题型,侧重于元素化合物知识的综合应用,题中注意氧化铝和二氧化硅的性质,题目难度不大.

练习册系列答案
相关题目
14.下列实验操作能实现符合题中要求的是( )
| A. | 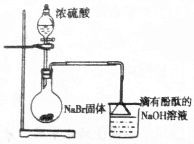 能证明制取HBr的现象使烧杯中红色褪去 | |
| B. | 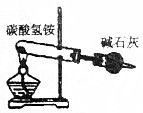 实验室可用此装置制取氨气 | |
| C. | 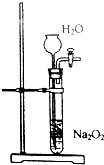 可以用于实验室制取氧气 | |
| D. | 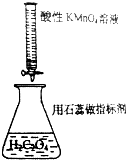 用KMnO4滴定H2C2O4 |
2.能在空气中稳定保存的物质是( )
| A. | 氢氧化亚铁 | B. | 过氧化钠 | C. | 镁条 | D. | 氯水 |
19.已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
| A. | 溶液甲的 pH>7 | |
| B. | 对溶液甲进行微热,K1、K2 同时增大 | |
| C. | 若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大 | |
| D. | 若在溶液甲中加入 5 mL 0.1 mol•L-1 的盐酸,则溶液中醋酸的 K1 会变大 |
6.类推的思维方法在化学学习中应用广泛,以下类推结论正确的是( )
| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
16.下列化学反应中属于吸热反应的是( )
| A. | 干冰的升华 | |
| B. | 铝热反应 | |
| C. | 八水合氢氧化钡与氯化铵固体粉末混合 | |
| D. | 铜与浓硝酸反应 |
20.有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:①HA+HC2-(少量)═A-+H2C-②H2B(少量)+2A-═B2-+2HA ③H2B(少量)+H2C-═HB-+H3C下列反应的离子方程式中不正确的是( )
| A. | 2HA+C3-═2A-+H2C- | B. | H3C+3A-═3HA+C3- | ||
| C. | H3C+B2-═HB-+H2C- | D. | HB-+A-═HA+B2- |