题目内容
8.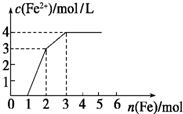 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.(1)横坐标0~1段反应的离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O.
(2)忽略溶液体积的变化,则原溶液c(NO3-)为9mol/L.
分析 根据氧化性:HNO3>Fe3+>Cu2+,Fe先与氧化性强的物质反应,0~1段发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,1~2段发生反应:Fe+2Fe3+=3Fe2+,2~3段发生反应Fe+Cu2+═Fe2++Cu,据此结合图象数据进行计算.
解答 解:(1)根据氧化性:HNO3>Fe3+>Cu2+,0~1段为Fe与硝酸反应,反应方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应的离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,
故答案为:Fe+NO3-+4H+=Fe3++NO↑+2H2O;
(2)原溶液中的硝酸根离子来自硝酸铁、硝酸铁和硝酸,
0~1段发生反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,总共消耗1molFe,则原溶液中含有硝酸的物质的量为1mol×$\frac{4}{1}$=4mol,同时反应生成1mol硝酸铁;
1~2段发生反应为Fe+2Fe3+=3Fe2+,该段消耗1molFe,则生成的亚铁离子的物质的量为:1mol×3=3mol,亚铁离子浓度为3mol/L,则该溶液体积为1L;此时溶液中消耗硝酸铁的物质的量为:1mol×2=2mol,则原溶液中含有硝酸铁的物质的量为:2mol-1mol=1mol;
2~3段发生反应为Fe+Cu2+═Fe2++Cu,该段总共消耗1mol铁,说明原溶液中含有硝酸铁的物质的量为1mol;
则原溶液中含有硝酸根离子的物质的量为:n(NO3-)=3n[Fe(NO3)3]+2n[Cu(NO3)2]+n(HNO3)=1mol×3+1mol×2+4mol×1=9mol,
该溶液体积为1L,则原溶液中硝酸根离子浓度为:c(NO3-)=$\frac{9mol}{1L}$=9mol/L,
故答案为:9mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
| A. | 溶液甲的 pH>7 | |
| B. | 对溶液甲进行微热,K1、K2 同时增大 | |
| C. | 若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大 | |
| D. | 若在溶液甲中加入 5 mL 0.1 mol•L-1 的盐酸,则溶液中醋酸的 K1 会变大 |
| A. | 干冰的升华 | |
| B. | 铝热反应 | |
| C. | 八水合氢氧化钡与氯化铵固体粉末混合 | |
| D. | 铜与浓硝酸反应 |
| A. | 物质的量依次增大 | B. | 分子数相等 | ||
| C. | 质量不相等 | D. | 原子数依次减小 |
| A. | 2HA+C3-═2A-+H2C- | B. | H3C+3A-═3HA+C3- | ||
| C. | H3C+B2-═HB-+H2C- | D. | HB-+A-═HA+B2- |
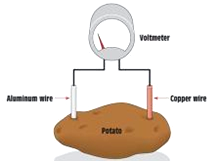 以色列研究人员宣布已研制出一种利用煮熟土豆发电的有机电池,具有构造简单、可持续利用等特点.图为土豆电池,这种绿色高效能的电池由锌、铜电极和煮熟的土豆片制成的.下列关于土豆电池叙述正确的是( )
以色列研究人员宣布已研制出一种利用煮熟土豆发电的有机电池,具有构造简单、可持续利用等特点.图为土豆电池,这种绿色高效能的电池由锌、铜电极和煮熟的土豆片制成的.下列关于土豆电池叙述正确的是( )| A. | 锌为电池的正极 | |
| B. | 铜极上发生氧化反应 | |
| C. | 该电池工作时电子由锌电极经外电路流向铜电极 | |
| D. | 该电池是将电能转化为生物质能 |