题目内容
4.下列有关物质性质和用途的描述,正确的是( )| A. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| B. | 浓硫酸具有吸水性,可用浓硫酸干燥SO2、H2S、NO2等气体 | |
| C. | 常温下,铝比铁耐腐蚀,可用铝锅长期盛放酸性食物 | |
| D. | 氨气与氯气能反应生成氯化铵,可用浓氨水检验输送氯气的管道是否有泄漏 |
分析 A.氢氟酸是弱酸;
B.浓硫酸具有强氧化性能氧化还原性的物质;
C.铝的表面有致密的氧化膜,能与酸反应;
D.浓氨水被氯气氧化为氮气和氯化氢,氯化氢和氨气生成白色烟.
解答 解:A.氢氟酸是弱酸,氢氟酸能与二氧化硅反应,所以氢氟酸用于雕刻玻璃,故A错误;
B.浓硫酸具有吸水性,可用浓硫酸干燥,浓硫酸具有强氧化性能氧化还原性的物质,所以浓硫酸不能干燥H2S,故B错误;
C.铝的表面有致密的氧化膜,铝比铁耐腐蚀,但是氧化铝和Al都能与酸反应,所以不能用铝锅长期盛放酸性食物,故C错误;
D.浓氨水被氯气氧化为氮气和氯化氢,氯化氢和氨气生成白色烟,所以输送氯气的管道有泄漏会产生大量白烟,故D正确.
故选D.
点评 本题考查了氢氟酸的性质、浓硫酸的性质与用途、铝的性质、氯气的性质等,掌握物质性质与物质用途是解题关键,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
7.下列有关化学用语和概念的表达理解正确的是( )
| A. | 立体烷 和苯乙烯 和苯乙烯 互为同分异构体 互为同分异构体 | |
| B. | 1,3-丁二烯的键线式可表示为 | |
| C. | 二氟化氧分子电子式为  | |
| D. | H216O、D216O、H218O、D218O互为同素异形体 |
15. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO,PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
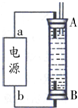
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放热(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可)
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO,PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可)
12.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ/mol下列说法正确的是( )
| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 放热反应的反应速率总是大于吸热反应的反应速率 |
19.已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
CH3COOH+H2O?CH3COO-+H3O+K1=1.75×10-5 mol•L-1
CH3COO-+H2O?CH3COOH+OH-K2=5.71×10-10 mol•L-1
现将 50mL 0.2mol•L-1 醋酸与 50mL 0.2mol•L-1 醋酸钠溶液混合制得溶液甲,下列叙 述正确的是( )
| A. | 溶液甲的 pH>7 | |
| B. | 对溶液甲进行微热,K1、K2 同时增大 | |
| C. | 若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大 | |
| D. | 若在溶液甲中加入 5 mL 0.1 mol•L-1 的盐酸,则溶液中醋酸的 K1 会变大 |
9.化学与社会、生活密切相关.下列说法错误的是( )
| A. | 碘酒是指碘单质的乙醇溶液 | |
| B. | 浓硫酸可以刻蚀石英制艺术品 | |
| C. | 84消毒液的有效成分是NaClO | |
| D. | 氢氧化铝、小苏打等可用于治疗胃酸过多 |
16.下列化学反应中属于吸热反应的是( )
| A. | 干冰的升华 | |
| B. | 铝热反应 | |
| C. | 八水合氢氧化钡与氯化铵固体粉末混合 | |
| D. | 铜与浓硝酸反应 |
13.同温同压下,对等体积的气体NH3、CO2、HCl来说,错误的是( )
| A. | 物质的量依次增大 | B. | 分子数相等 | ||
| C. | 质量不相等 | D. | 原子数依次减小 |
14.下列物质在氢氧化钠溶液和加热条件下反应后生成的对应有机物中,能够能被催化氧化成醛的是( )
| A. | (CH3)2CHCl | B. | CH3C(CH3)2Br | C. | (CH3)3CCOOCH(CH3)2 | D. | CH3C(CH3)2CH2Br |