题目内容
9.下列变化不需要破坏化学键的是( )| A. | 加热氯化铵 | B. | 干冰气化 | C. | 水通电分解 | D. | 氯化氢溶于水 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.分解生成HCl和氨气,离子键破坏,故A不选;
B.干冰气化,只破坏分子间作用力,故B选;
C.分解生成氢气和氧气,共价键破坏,故C不选;
D.发生电离,共价键破坏,故D不选;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
19.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.图为N2(g)和O2(g)生成NO(g)过程中的能量变化

下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
20.下列与胶体的有关性质的描述错误的是( )
| A. | 将盐卤或石膏加入豆浆,制成美味可口的豆腐 | |
| B. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀,即可制得Fe(OH)3胶体 | |
| C. | 放电影时,放映室射到屏幕上的光柱 | |
| D. | 在盛有红褐色Fe(OH)3胶体的U形管两端加上直流电压后,阴极附近颜色逐渐加深 |
17.下列各组物质中,都是强电解质的是( )
| A. | HBr、HCl、BaSO4 | B. | NH4Cl、CH3COONa、Na2S | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、NaF、Ba(OH)2 |
4.松花蛋,又称皮蛋.其中一种加工工艺的主要原料配方为:将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍.
请回答下列问题:
(1)生石灰加入沸水中,写出该化学反应的化学方程式CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热.
(2)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色.
(3)取上层清液分析,一定含有的溶质NaOH、NaCl.可能还含有其它溶质,但不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(用化学方程式表示).
(4)你认为可能含有的溶质Na2CO3或Ca(OH)2,并用实验证明.
(5)皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是发生酸碱中和反应.
(6)在上述反应过程中,没有涉及到的化学反应类型分解反应、置换反应.
请回答下列问题:
(1)生石灰加入沸水中,写出该化学反应的化学方程式CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热.
(2)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色.
(3)取上层清液分析,一定含有的溶质NaOH、NaCl.可能还含有其它溶质,但不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(用化学方程式表示).
(4)你认为可能含有的溶质Na2CO3或Ca(OH)2,并用实验证明.
| 实验步骤 | 实验现象 |
(6)在上述反应过程中,没有涉及到的化学反应类型分解反应、置换反应.
14.下列物质的类别与所含官能团都表达错误的是( )
| A. | 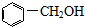 醇类-OH 醇类-OH | |
| B. | CH3CH2CH2COOH 羧酸-COOH | |
| C. | 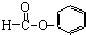 醛类-CHO 醛类-CHO | |
| D. | CH3-O-CH3 醚类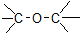 |
1.认识反应条件对化学反应的影响,对学好化学有重要意义.下列说法中正确的是( )
| A. | 镁在空气中或纯净氧气中燃烧的产物都只有MgO | |
| B. | 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 | |
| C. | 将四氧化三铁溶解于过量的硝酸中,所得溶液中无Fe2+ | |
| D. | 氯化铝和过量的氨水反应一定得到Al(OH)3沉淀 |
18.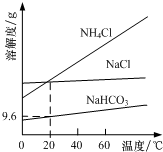 以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
 以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )| A. | 将NaHCO3加热分解可得纯碱 | |
| B. | 常温下碳酸氢钠的溶解度大于碳酸钠 | |
| C. | 采用蒸发结晶从溶液中分离出NaHCO3 | |
| D. | 20℃时,NaHCO3饱和溶液的物质的量浓度约为1.1mol/L |
19.工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
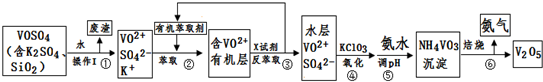
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作I的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移提高了钒的萃取率.
③中X试剂为硫酸.
(3)④的离子方程式为NH3•H2O+VO3-═NH4VO3↓+OH-.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为1.7-1.8.
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.

请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作I的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移提高了钒的萃取率.
③中X试剂为硫酸.
(3)④的离子方程式为NH3•H2O+VO3-═NH4VO3↓+OH-.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.