题目内容
14.下列物质的类别与所含官能团都表达错误的是( )| A. | 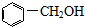 醇类-OH 醇类-OH | |
| B. | CH3CH2CH2COOH 羧酸-COOH | |
| C. | 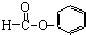 醛类-CHO 醛类-CHO | |
| D. | CH3-O-CH3 醚类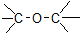 |
分析 A.含有-OH,且与苯环不直接相连;
B.含有-COOH;
C.含有-COO-;
D.含有-C-O-C-.
解答 解:A.因 中含有-OH,且与苯环不直接相连,为苯甲醇,属于醇,故A正确;
中含有-OH,且与苯环不直接相连,为苯甲醇,属于醇,故A正确;
B.CH3CH2CH2COOH中含有-COOH,为丁酸,属于羧酸,故B正确;
C. 中含有-COO-,为甲酸苯酚酯,属于酯类物质,故C错误;
中含有-COO-,为甲酸苯酚酯,属于酯类物质,故C错误;
D.CH3-O-CH3中含有-C-O-C-,为甲醚,属于醚类,故D正确;
故选C.
点评 本题考查有机物的官能团及物质类型,明确常见有机物的官能团是判断物质类别的关键,题目较简单.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
4.某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;
②溴单质易挥发,碘单质易升华;
③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
实验方案:该小组设计如图所示装置实验(夹持仪器已略去,装置气密性完好)
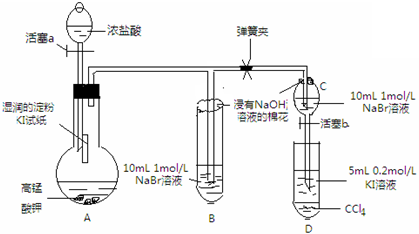
实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
实验目的:探究Cl2、Br2、I2的氧化性强弱.
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;
②溴单质易挥发,碘单质易升华;
③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示.
| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |

实验过程:
Ⅰ先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ…
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是A中湿润的淀粉碘化钾试纸变蓝,写出该反应的化学方程式Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,写出该反应的离子方程式2I-+Br 2=2Br-+I2;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为Cl2>Br2>I2;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
5.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色 |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.比较AgCl和AgI的 Ksp大小 | 向10mL浓度均为0.01mol/L的NaCl和KI混合溶液滴加少量0.01mol/L AgNO3溶液,观察现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
2.在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
则下列说法中正确的是( )
| 物质 | A | B | C | D |
| 反应前质量(g) | 4 | 6 | 111 | 4 |
| 反应后质量(g) | 待测 | 15 | 0 | 84 |
| A. | 该反应的反应物为A和C | |
| B. | 容器中发生的化学反应,属于分解反应 | |
| C. | 反应后,生成了84g D物质 | |
| D. | 反应后,待测A的质量为26 g |
9.下列变化不需要破坏化学键的是( )
| A. | 加热氯化铵 | B. | 干冰气化 | C. | 水通电分解 | D. | 氯化氢溶于水 |
19.下列装置应用于实验室进行相关实验,能达到实验目的是( )
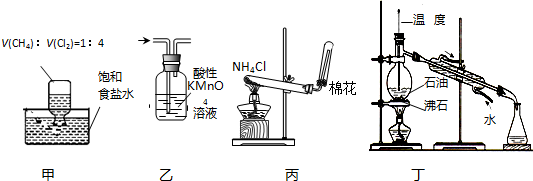

| A. | 用装置甲在光照条件下验证甲烷与氯气的反应 | |
| B. | 用装置乙除去甲烷中少量的乙烯得纯净甲烷 | |
| C. | 装置丙用于实验室制取NH3 | |
| D. | 用装置丁分馏石油并收集60~150℃馏分 |
6.下列关于有机物的说法中,不正确的是( )
| A. | 糖类、有脂和蛋白质都能发生水解反应 | |
| B. | 乙烯、氯乙烯均可用于合成塑料 | |
| C. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| D. | 分子式为C6H14的有机物只有5种,它们属于同分异构体 |
3.下列关于某些社会热点问题的说法中,错误的是( )
| A. | 甲醛是某些劣质装饰板材释放的常见污染物之一 | |
| B. | 光化学烟雾的产生与人为排放氮氧化物有关 | |
| C. | 臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关 | |
| D. | 禁止使用含铅汽油是为了提高汽油的燃烧效率 |

 ;
; .
.